上海大学苏佳灿:3D打印GelMA/ AlgMA/羟基磷灰石支架用于构建功能性骨类器官
时间:2024-05-17 11:47 来源:EFL生物3D打印与生物制造 作者:admin 点击:次
| 应对大骨缺损仍然是一个重大挑战,因为自愈能力的固有限制导致了长时间的康复和亚优化再生。虽然目前有临床解决方案可用,但它们存在明显的缺点,需要更有效的骨再生方法。源自干细胞的器官样结构在这个领域显示出巨大潜力;然而,骨器官样结构的发展受到特定需求的限制,包括需要由支架和混合细胞外基质(ECM)提供坚固的机械支持。在这种背景下,生物打印技术已经成为复制骨组织复杂结构的强大手段。 来自上海大学的苏佳灿等团队与来自上海第六人民医院的施忠民团队合作开发了一种利用新型生物墨水(GelMA/AlgMA/羟基磷灰石)制造高度复杂的骨细胞外基质模拟物的方法。生物打印支架有助于长期培养和逐渐成熟的大规模生物打印骨器官样结构,促进多细胞分化,并为骨形成的初始阶段提供有价值的见解。本研究的生物墨水的内在自矿化特性与天然骨的性质非常接近,为器官样结构赋予了增强的骨修复能力,适用于体外和体内应用。这项开创性的研究推动了骨组织工程领域的发展,并在将其转化为实际应用方面具有重大的潜力。相关工作以题为“Engineering Large-Scale Self-Mineralizing Bone Organoids with Bone Matrix-Inspired Hydroxyapatite Hybrid Bioinks”的文章发表在2024年04月20日的国际顶级期刊《Advanced Materials》。 
1. 创新型研究内容 本研究开发了一种生物墨水配方来模拟骨的复杂细胞外基质(ECM)的方法,该配方将羟基磷灰石与Gelatin Methacrylate和Alginate Methacrylate(GelMA/AlgMA)等有机聚合物结合在一起。所得的生物墨水具有独特的自我矿化和细胞分化能力。当用于生物打印骨器官样结构支架时,这些构建物在体外和体内都显示出功能性的机械支持、长期细胞培养和自我矿化能力。值得注意的是,在体内培养时,生物打印的器官样结构演变为类似梭形骨的结构,表明骨器官样结构的高度成熟性和其与天然海绵骨的机械相似性。值得注意的是,GelMA和GelMA/AlgMA等有机生物墨水无法形成骨器官样结构。这项开创性的研究标志着首次成功制备了用于生物打印骨器官样结构支架的混合生物墨水,并强调了无机成分在骨器官样结构发展中的重要性,为进一步研究骨发育初期的分化和基质形成铺平了道路。受合成骨基质启发的具有自我矿化性能的生物墨水使得工程化的骨器官样结构能够密切模拟天然骨组织的结构、功能和再生潜力。这一进展的影响扩展到骨组织工程的各种应用,包括疾病建模、药物筛选、个性化医学和再生医学。 【生物墨水和印刷支架的表征】 这些生物墨水表现出良好的可打印性,能够产生精细的模型,包括兔子模型,具有高精度的打印,即使在几毫米大小的尺寸上也能保持如此。为评估多孔打印能力,本研究打印了多孔支架。从顶视图的分析中可以看出,即使在孔径为50微米的情况下,所有孔隙都能够一致地打印出来。本研究选择了一个具有优势多孔结构的代表性圆柱支架用于后续的生物实验,因为这种结构有利于营养物质的传递和细胞生长(图1A)。扫描电子显微镜图像证实,打印的支架具有精确的多孔结构,适合于胞载体应用。此外,GelMA/AlgMA/HAP打印的支架表面发现了Ca/P元素(图1C),而GelMA和GelMA/AlgMA支架没有出现Ca/P元素。为减轻冻干后水凝胶的形态改变,本研究进行了冷冻扫描电子显微镜观察。GelMA/AlgMA/HAP水凝胶展示了更均匀的微孔结构。这对于成骨细胞矿化和构建纳米到微米级别的骨梁是有利的(图1B)。通过分析应力-应变曲线在弹性区域的斜率,特别是初始线性部分,确定了水凝胶的抗压模量。值得注意的是,使用GelMA/AlgMA/HAP生物墨水的组具有比单独使用GelMA的组更大的断裂应变(图1D)。复合水凝胶的抗压强度和抗压模量依次为50 kPa / 0.09 MPa,57 kPa / 0.12 MPa,和170 kPa / 0.40 MPa,分别对应GelMA,GelMA/AlgMA和GelMA/AlgMA/HAP(图1E-F)。与GelMA水凝胶相比,引入AlgMA导致了抗压强度和模量的增加,但差异在统计学上没有显著。此外,GelMA/AlgMA/HAP的抗压模量显著增加了约400%(图1F)。 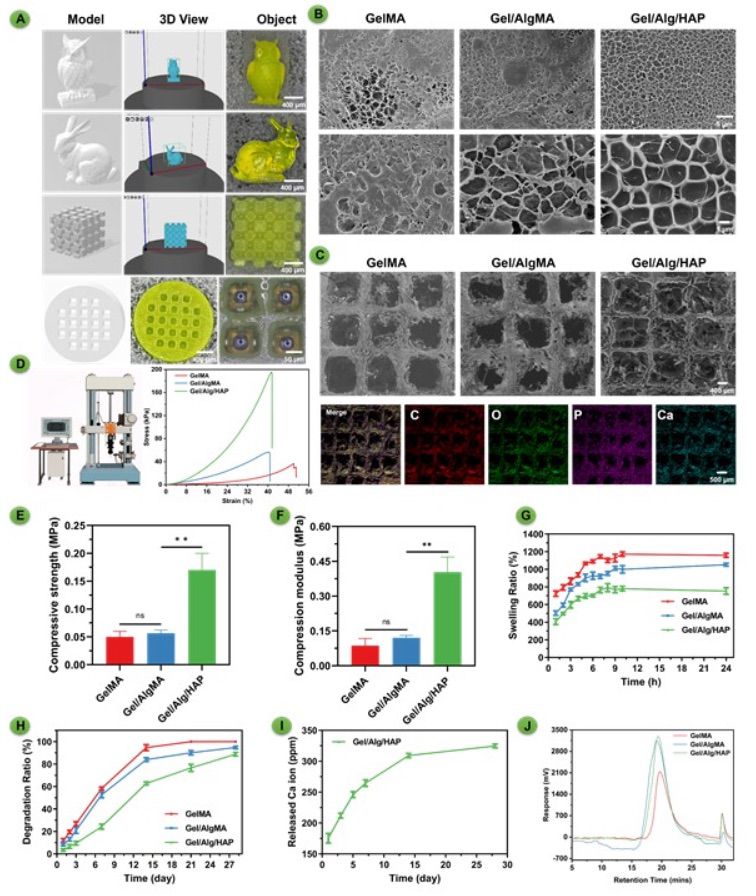
图1 对合成的GelMA、GelMA/AlgMA和GelMA/AlgMA/HAP生物墨水以及它们相应的支架进行分析和评估
【3D生物打印支架可在体外维持长期细胞培养】 确保细胞的良好存活、附着和增殖对于工程组织支架非常重要,特别是对于封装细胞的支架(图2)。骨髓间充质干细胞(BMSCs)被封装在生物墨水中,并打印成支架形状(图2A)。活/死细胞检测结果有力地证明,在整个14天的培养期间,所有组的细胞存活良好,验证了生物墨水能够维持BMSCs的长期存活能力(图2C-D)。在初次打印时,细胞均匀分布在生物墨水中,呈现为离散的点状。然而,随着时间的推移,观察到一个值得注意的现象。BMSCs向支架表面迁移,逐渐增殖并扩展其存在,最终形成复杂的三维细胞网络。这些细胞网络在培养7天后变得越来越明显,伴有扩展的细胞细胞骨架。这些有力的观察共同强调,在体外逐渐降解的同时,生物打印的支架保持结构稳定,能够支持BMSCs的培养。CCK-8试验的结果也证实了这些发现(图2B)。总体而言,本研究凸显了三维生物打印的胞载体支架在长期培养过程中有效地促进细胞的存活和生长,为骨器官样结构的形成奠定了基础。 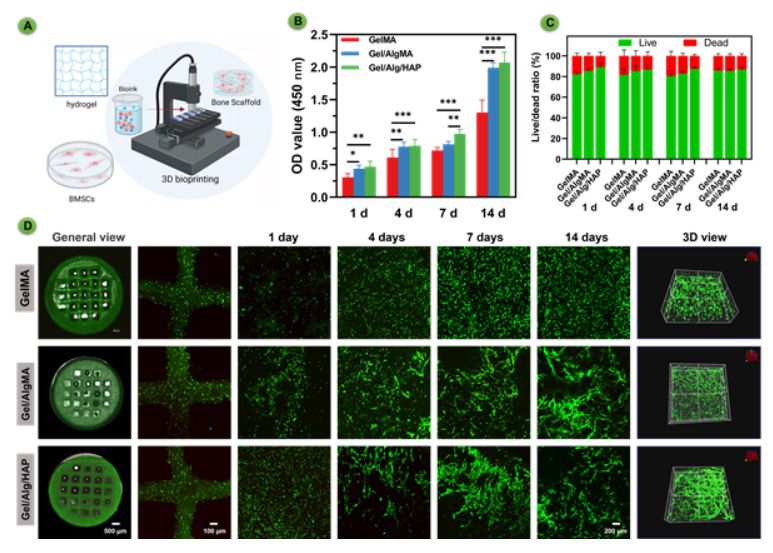
图2 生物打印的负载骨髓间充质干细胞(BMSCs)的GelMA、GelMA/AlgMA和GelMA/AlgMA/HAP支架的生物相容性评估
【体外 3D 生物打印支架增强成骨分化】 在成功展示了生物打印支架的长期细胞培养潜力后,本研究进行了一个关键的验证步骤,评估其作为干细胞载体形成复杂骨器官样结构的能力。为进一步评估不同组的成骨潜能,本研究在体外培养40天后对支架进行了碱性磷酸酶(ALP)和茜素红(ARS)染色。ALP染色显示GelMA/AlgMA/HAP组的ALP表达最高。ARS染色用于研究不同支架中BMSCs的矿化水平。ARS与钙形成橙红色螯合物,作为骨成骨矿化的指示物。GelMA和GelMA/AlgMA在茜素红染色中显示出最低的钙或磷含量。相反,GelMA/AlgMA/HAP显示出明显的钙和磷沉积,以及更多的钙化结节(图3A)。在体外培养14天后,我们通过测量ALP和ARS活性定量评估了BMSCs分化成成骨细胞的情况。GelMA/AlgMA/HAP组的ALP和ARS活性分别为2.01 ± 0.14和1.74 ± 0.11,比GelMA组分别高出近6倍和9倍(图3B-C)。本研究对支架进行了溶解,并通过RT-PCR进一步评估所获得的细胞。RT-PCR分析显示,与其他两组相比,GelMA/AlgMA/HAP组中成骨相关基因(包括Runx2、Col1A1、OCN和OPN)的表达水平明显升高(图3D)。GelMA/AlgMA组中Runx2、OCN和OPN的表达水平与GelMA组相比没有显著差异。然而,GelMA/AlgMA组中Col1A1的表达水平显著升高,与GelMA组相比,这表明AlgMA增强了胶原蛋白的产生。为进一步验证成骨相关蛋白的表达,进行了免疫印迹分析。免疫印迹结果表明,GelMA/AlgMA/HAP组中成骨相关蛋白(Runx2、BMP-2和OCN)的表达显著高于GelMA和GelMA/AlgMA组(图3E)。这进一步证明了GelMA/AlgMA/HAP不仅在基因水平上促进成骨,而且在蛋白水平上能够增强成骨相关蛋白的表达。此外,图像显示,GelMA打印的支架边界更清晰,而GelMA/AlgMA/HAP显示出更模糊的边界,表明细胞在GelMA/AlgMA/HAP生物墨水中生长和扩展。这些发现表明,形成骨器官样结构的GelMA/AlgMA/HAP生物墨水可以诱导成骨分化和组织重塑。 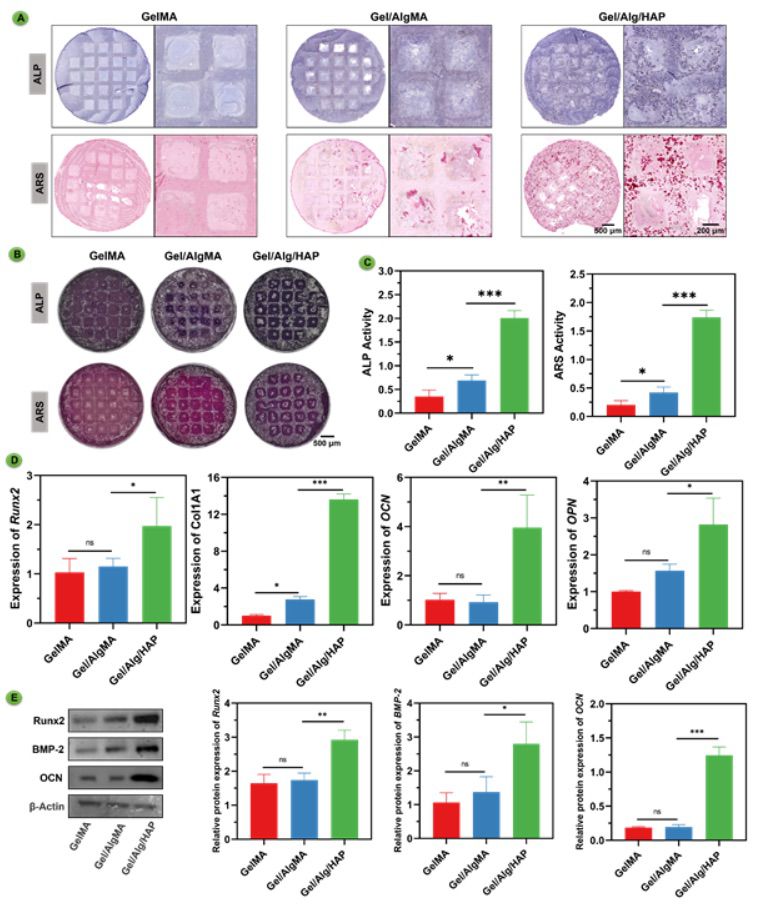
图3 生物打印的GelMA、GelMA/AlgMA和GelMA/AlgMA/HAP支架在体外增强了成骨能力
【骨类器官的体外自矿化】 在培养40天期间,使用微CT监测(图4)研究了生物打印的支架在体外矿物质形成和成熟过程中的情况。本研究将三组生物三维打印的支架在体外培养20天和40天,并使用微CT进行了体外矿化研究(图4A)。微CT图像显示了GelMA、GelMA/AlgMA和GelMA/AlgMA/HAP在20天和40天的矿物质形成情况(图4F-G)。在40天的培养期间,GelMA和GelMA/AlgMA几乎没有矿物质形成,而GelMA/AlgMA/HAP显示出大量矿物质沉积。因此,体外培养40天的GelMA/AlgMA/HAP生物打印支架被确认为骨器官样结构。在最初的20天内,矿化主要发生在支架的外部。然而,20天后,矿化扩展到支架的内部。从侧面观察,矿化组织在支架表面上呈现出比内部更均匀的生长。相反,另外两组在一段时间后没有显示出完整的支架结构。在20至40天期间,只有少数矿化斑点出现在GelMA和GelMA/AlgMA中,这表明在这些组中自我矿化过程主要发生在20天后。为评估HAPs的影响,还设置了一个对照组,其中包括未加载细胞的支架材料。然而,这些材料在没有BMSCs的情况下无法矿化,并且在充分膨胀平衡后在微CT下没有显示出高密度信号。经过20天浸泡,未加载BMSCs的GelMA/AlgMA/HAP没有自我矿化。本研究还在时间上量化了总矿物体积(TMV)和器官样矿物密度(OMD)(图4B-C)。在第20天,GelMA/AlgMA/HAP组的TMV显著高于其他组,而GelMA和GelMA/AlgMA组之间没有显著差异。 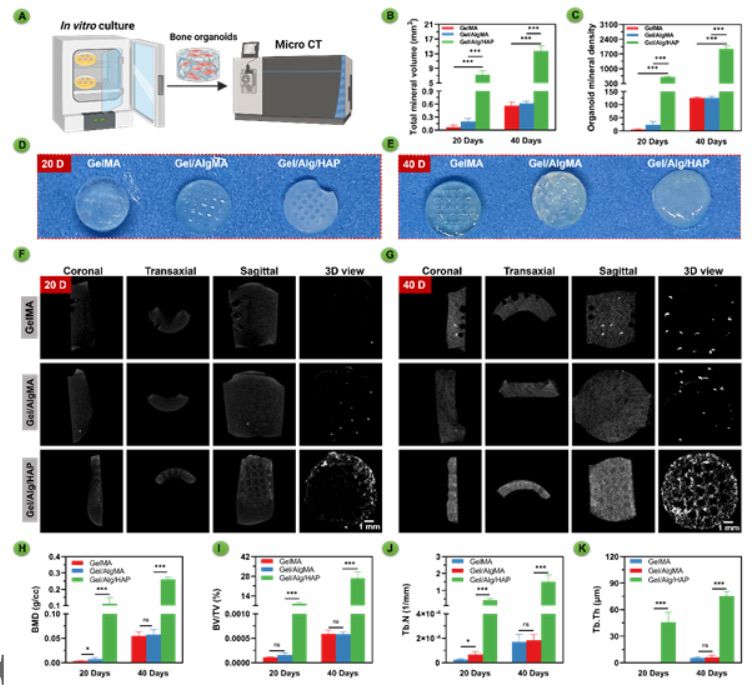
图4 GelMA、GelMA/AlgMA生物打印支架以及GelMA/AlgMA/HAP生物打印骨器官样结构在体外表现出自我矿化能力
【体内骨类器官的形成和自我矿化】 为进一步研究它们在体内重塑成大型和成熟的骨组织的能力,本研究通过在裸鼠皮下植入验证了它们在体内骨器官样结构形成中的应用。为更准确地模拟体内细胞生长微环境,在体外培养三天后将三维生物打印的水凝胶支架皮下植入裸鼠体内。在不同的时间点评估支架的自我矿化和骨器官样结构形成(图5A)。使用HE染色的组织切片进行研究,发现生物打印的支架内存在各种细胞类型(图5B)。这表明BMSCs的有效分化。对于GelMA和GelMA/AlgMA,一个有趣的发现是,特别是在支架的中心区域,某些区域保持相对完整,表明缺乏细胞。在这些组中,细胞主要分布在支架的边缘。与之形成鲜明对比的是,在GelMA/AlgMA/HAP中,细胞表现出在整个支架上均匀扩散的显著能力。本研究对关键骨相关因子和骨基质的关键成分(如OCN、OPN和Runx2)进行了特定的免疫染色。这些分析揭示了GelMA/AlgMA/HAP组中强大的骨形成能力,突显了GelMA/AlgMA/HAP支持皮下骨发育的能力。相比之下,在GelMA和GelMA/AlgMA中,OPN和Runx2的表达主要在培养40天后增加(图5C)。重要的是,在20天时间点上,这些组中OPN和Runx2的表达水平显著低于GelMA/AlgMA/HAP骨器官样结构。免疫组织化学的定量数据显示,与GelMA和GelMA/AlgMA相比,GelMA/AlgMA/HAP中成骨蛋白(OCN、OPN和Runx2)的表达显著增加(图5D-F)。 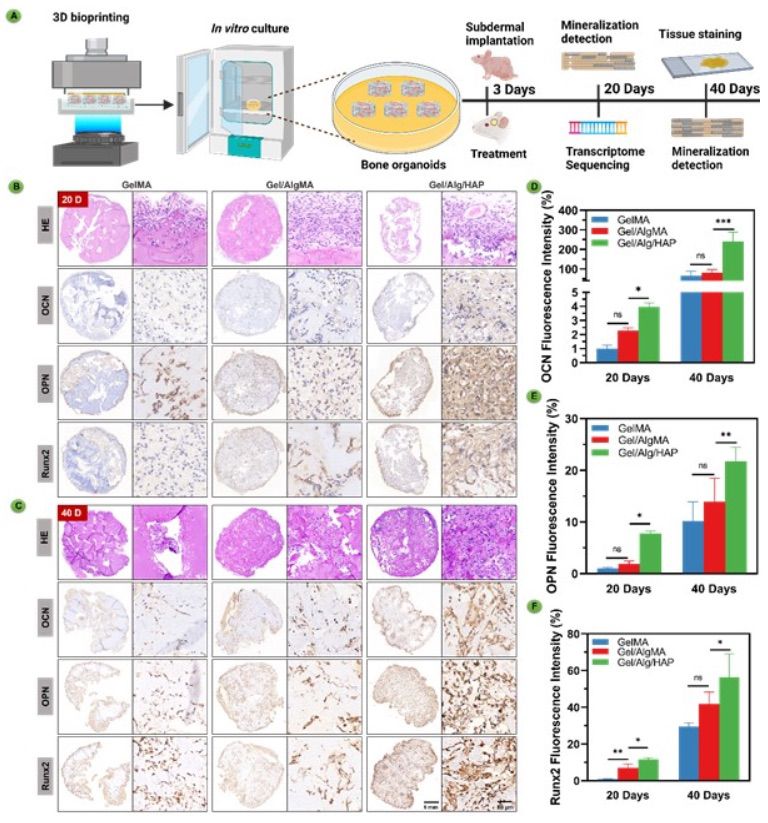
图5 GelMA、GelMA/AlgMA生物打印支架以及GelMA/AlgMA/HAP生物打印骨器官样结构在体内增强了成骨能力
定量数据证实了本研究的视觉观察。为进一步证实BMSCs的分化,对胶原II、危险脂肪素和骨膜素等标记物进行了免疫荧光染色(图6A-B)。GelMA/AlgMA/HAP中存在危险脂肪素+和骨膜素+细胞,证实了脂肪组织和成骨细胞的存在。相反,在另外两组中,在20天和40天时这些差异几乎不可观察到。GelMA/AlgMA/HAP的免疫荧光染色结果显示胶原II呈阳性,表明软骨细胞的存在。与20天的体内培养相比,40天的荧光强度明显较弱,这表明GelMA/AlgMA/HAP中的骨化可能是通过内生软骨骨化进行的,定量荧光数据证实了这些观察结果(图6C-E)。 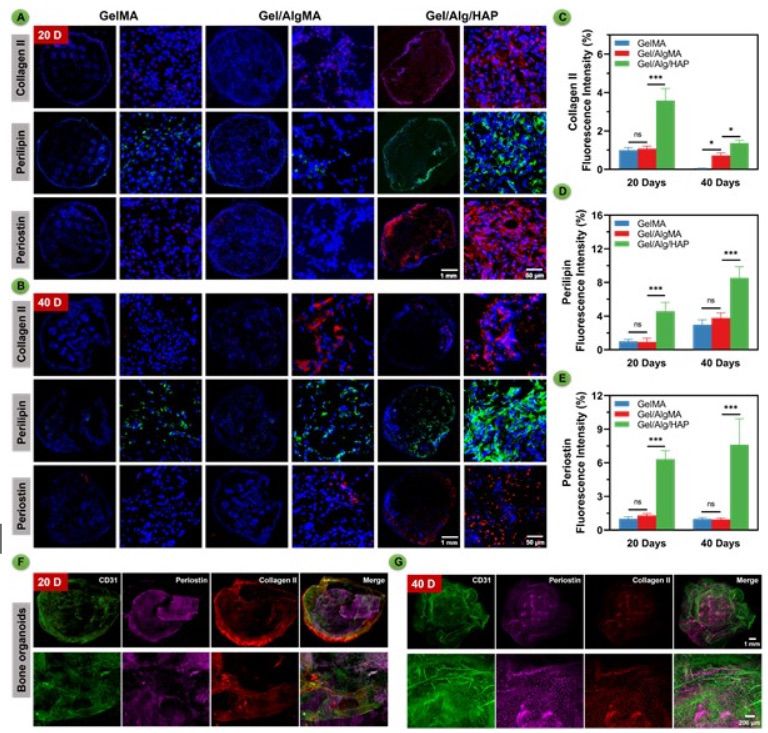
图6 GelMA、GelMA/AlgMA生物打印支架以及GelMA/AlgMA/HAP生物打印骨器官样结构在体内形成,并展现多细胞分化的能力
根据免疫荧光染色的结果,本研究将在体内培养20天的GelMA/AlgMA/HAP生物打印支架描述为“骨器官样结构”。本研究3D打印了水凝胶支架并将其皮下植入裸鼠体内,分别培养了20天和40天,然后进行了微CT研究体内的自我矿化(图7A)。羟基磷灰石生物打印支架在体内培养40天后保持其结构,并发展成为白色骨状结构(图7D-E)。相比之下,GelMA和GelMA/AlgMA呈软骨状结构。此外,GelMA/AlgMA和GelMA/AlgMA/HAP的表面上有更多的血管比GelMA。利用微CT评估了生物打印支架的矿化和骨体积(图7F)。微CT重建清楚地显示出GelMA/AlgMA/HAP生物打印的骨器官样结构发生了矿化,特别是在20天的体内培养后,骨样基质在边缘区域积累更多。相比之下,另外两组没有显示出矿化。在培养40天后,通过微CT观察到了GelMA/AlgMA/HAP打印的骨器官样结构的整个结构,包括多孔的结构(图7G)。在体内自我矿化研究中,本研究量化了TMV和OMD随时间的变化。在20天和40天时,GelMA/AlgMA/HAP的TMV和OMD显著高于其他组,而GelMA和GelMA/AlgMA之间没有显著差异(图7B-C)。 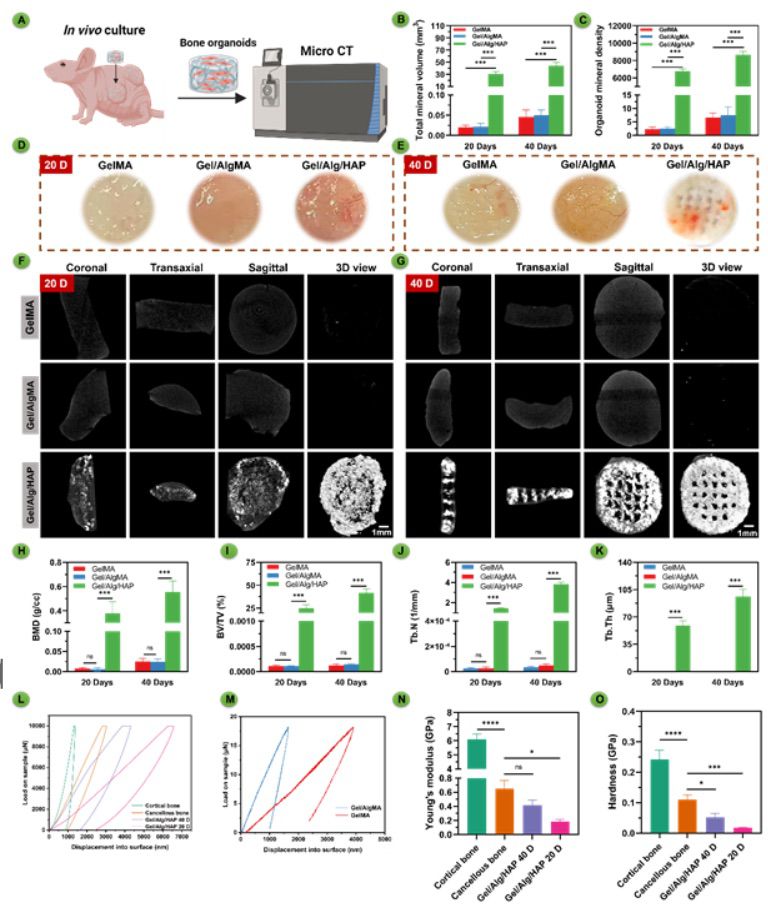
图7 GelMA、GelMA/AlgMA生物打印支架和GelMA/AlgMA/HAP生物打印骨器官样结构在体内表现出自我矿化能力
2. 总结与展望 总之,本研究成功地使用BMSCs在GelMA/AlgMA/HAP生物墨水中进行了大规模3D骨器官样结构的生物打印。这些生物墨水为封装的BMSCs提供了有利的环境,促进其活跃功能和自我矿化。在体内环境中,这些生物打印的骨器官样结构有效地引导骨生成、矿化、细胞层形成、塑性和重塑,最终促进了骨器官样结构的发展。与实际骨组织,尤其是松质骨相比,本研究构建的骨器官样结构具有类似松质骨的微观和纳米级多孔结构,明显的羟基磷灰石晶相,实现了全面的结构模拟。在机械性能方面,与当前的水凝胶构建相比,本研究将构建的骨器官样结构的机械强度提高了三个数量级,达到了GPa级,与SD大鼠的皮质骨没有显著差异。有趣的是,通过组织清除技术,本研究构建的骨器官样结构形成了类似网络状的血管腔。这项研究突显了使用GelMA/AlgMA/HAP骨器官样结构通过3D生物打印创建功能化和简化的骨修复生物框架的潜力。通过认识和解决骨器官样结构构建的独特需求和挑战,研究人员可以在选择合适的基质材料和生物墨水时做出明智的选择,从而推动骨组织工程和再生医学之间的界限。随着我们继续应对骨微环境的复杂性,未来可能会设计出大规模、功能增强的骨器官样结构,能够精确调控干细胞行为的多个方面,推动生物材料在骨组织再生方面的应用。 文章来源: https://onlinelibrary.wiley.com/doi/10.1002/adma.202309875 (责任编辑:admin) |