基于微流控制备载细胞核-壳结构微凝胶的3D打印骨再生结构的构建
时间:2021-08-18 10:25 来源:南极熊 作者:admin 点击:次
利用3D生物打印技术制备载细胞组织结构时,打印过程中的剪切应力显著降低了生物活性。已有研究证明,具有独立控制隔室的微凝胶可以在打印过程中保护细胞。近期,东华大学化学化工与生物工程学院和材料科学与工程学院的何创龙教授团队和周小军老师联合复旦大学附属浦东医院骨科的何家文医生提出利用基于微流控技术制备的核-壳结构的微凝胶封装细胞,以减少挤出生物3D打印过程中剪切应力对细胞的损伤,并在骨组织修复领域具有良好的应用前景。相关论文“Construction
of 3D printed constructs based on microfluidic microgel forbone
regeneration”发表于杂志Composites Part B上。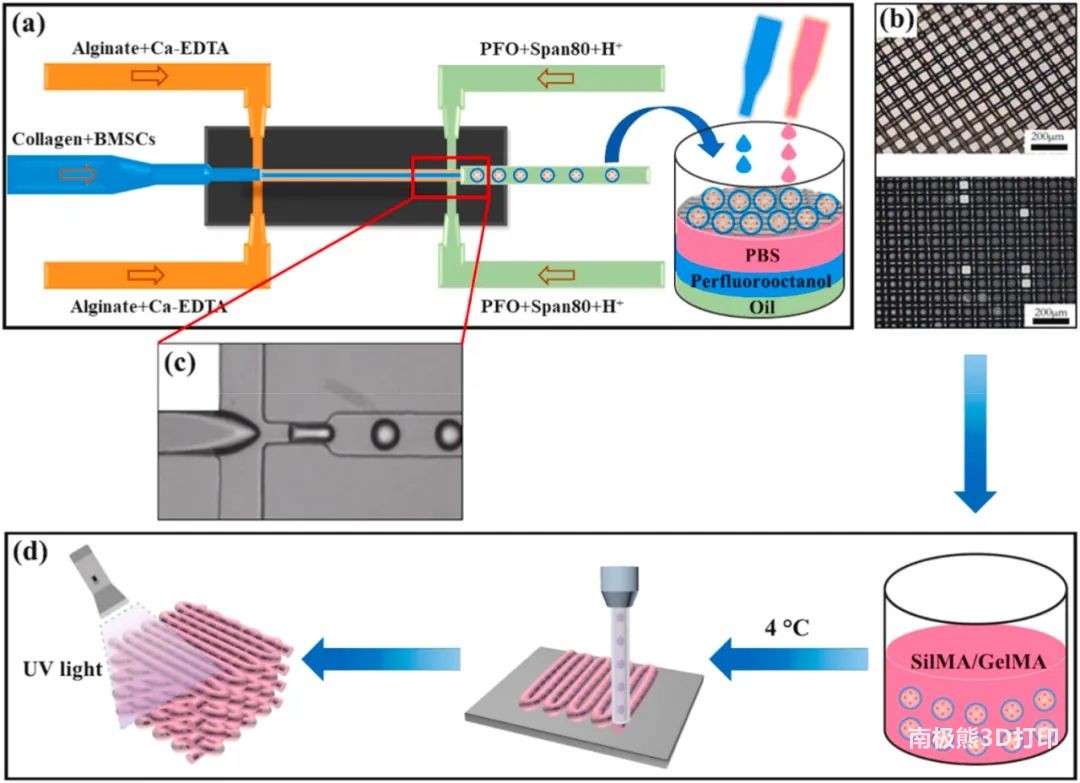
图1 载细胞微凝胶和 3D 打印载细胞微凝胶的制造过程示意图
1. 微流控制备核-壳结构的载细胞微凝胶 参数 油相:含有1v/v%司班80、0.01v/v%乙酸和0.8w/v% CaCl2-NP的液体石蜡 壳:2%w/v的海藻酸钠和50 mM Ca-EDTA混合溶液 核:含有GFP-BMSCs cells/mL的I型胶原溶液 流速:水相Qaqu /油相Qoil = 1/3,核相 Q1/壳相Q2 = 2 微凝胶制备过程(图1) 将核心溶液和壳溶液分别装入无菌微流控注射器的中间和两侧的注射器中,流速由注射泵独立控制,在微流体平台上制备载有细胞的微凝胶;然后,在收集过程中,使用PBS溶液(pH = 7.4)中和油相中的乙酸溶液;最后,将载有细胞的微凝胶重新悬浮在细胞培养基中进行体外培养。 表征 乙酸和 CaCl2 -NP浓度与微凝胶形态的关系:当 CaCl2-NP的浓度为0.8wt % 时,0.01 v/v%的乙酸溶液即可形成粒径均匀的微凝胶(图2)。 流速与微凝胶的粒径分散性和壳核结构的关系:粒径分散性随着流速比Qaqu/Qoil的减小而减小,尺寸也相应减小(图2);I型胶原相 (Q 1 )流速增加,核层厚度增加,壳层厚度相应减小(图3)。 醋酸浓度和Qaqu/Qoil的流速比对载细胞微凝胶细胞活力的影响(图4):随着乙酸浓度的降低和流速比的增加,细胞活力相应增加;使用这些参数制备的微凝胶具有良好的生物相容性。 
图2 乙酸、CaCl2 -NP浓度和流速对微凝胶形态的关系图
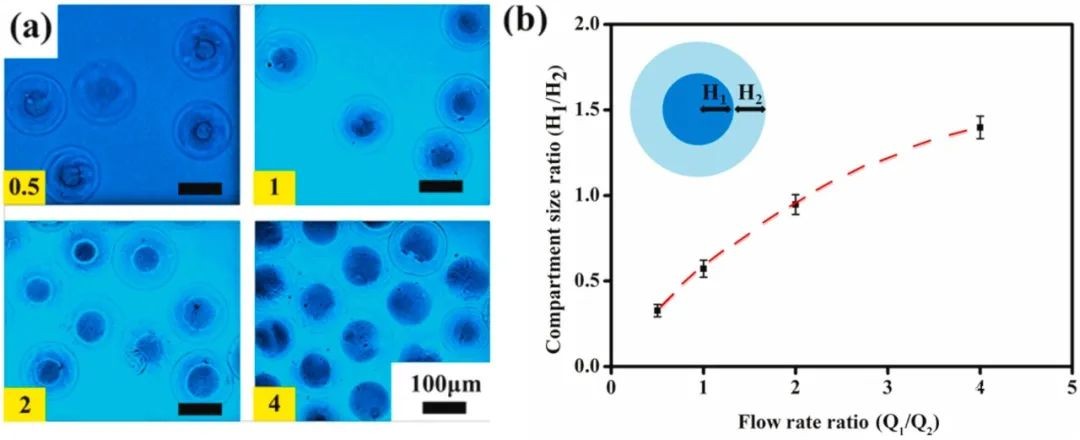
图3 流速与微凝胶壳-核的关系图
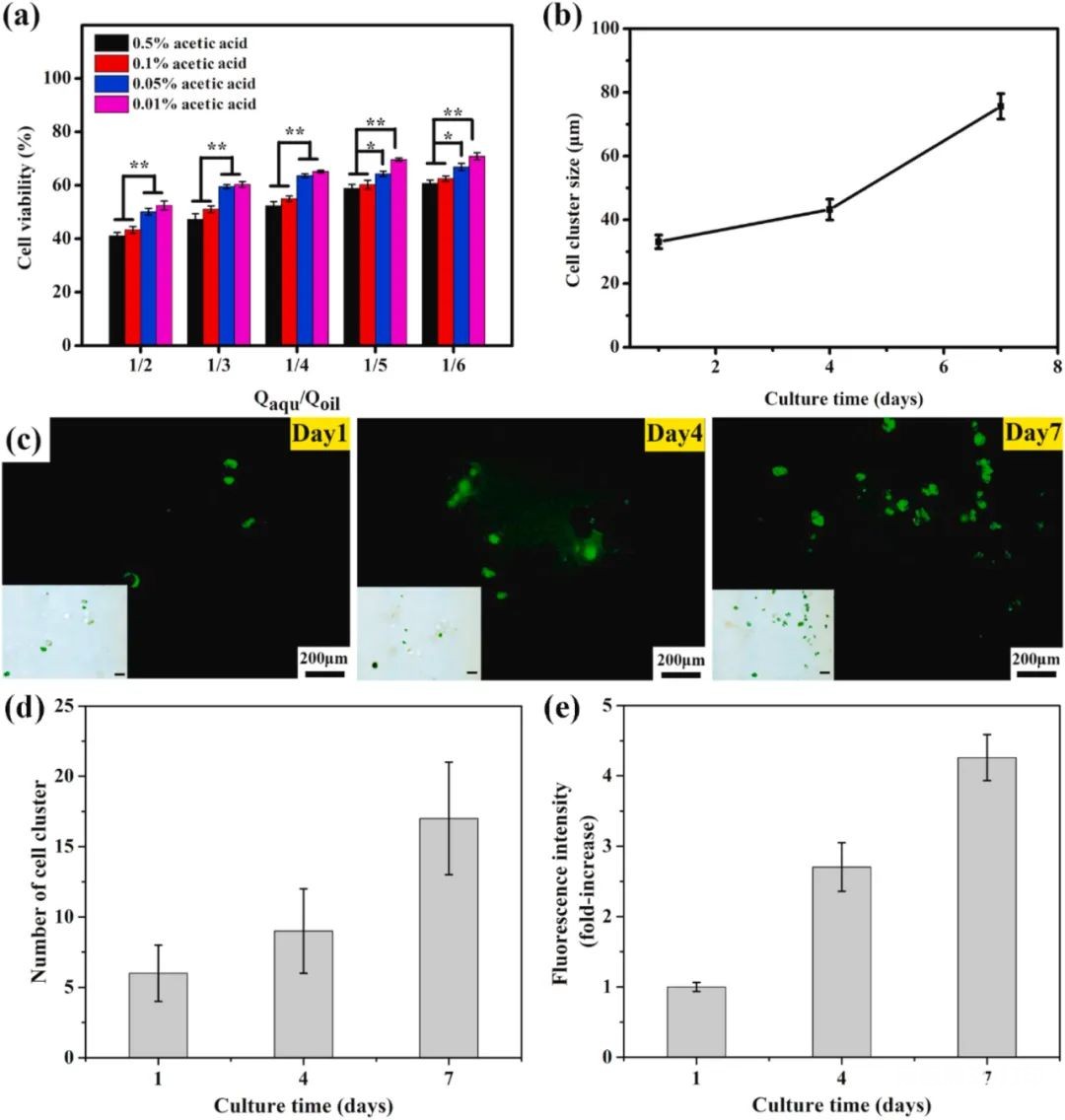
图4 载细胞微凝胶中细胞活力图
2. 3D载微凝胶结构的生物打印 打印参数 喷嘴内径为500 μm; 层高0.55mm,网格填充宽度1mm,轴速度3mm/s,气压值0.25 MPa; 墨水预处理温度4℃。 打印过程 将生物3D打印机放置在无菌室中,以确保打印过程的无菌性。2 mL载细胞微凝胶(5×10^5个细胞)与SilMA/GelMA 复合材料混合作为3D生物打印的生物墨水。为确保细胞数的一致性,将2 mL培养基(5×10^5个细胞)加入到不含微凝胶的bioink中作为对照组进行生物打印。3D打印体在UV照下(365nm,10秒)进行光交联,并转移到细胞培养板培养。 表征: 微凝胶结构对细胞活力的影响:3D打印的载细胞微凝胶结构的细胞活力高于载细胞3D打印结构,微凝胶在打印过程中对细胞的保护作用。 
图5 3D打印结构体的细胞增殖图
3. 3D打印结构促进骨组织再生 炎症反应:将Microgel-15%SilMA/GelMA和15%SilMA/GelMA 构建体置于 SD 大鼠的皮下,材料与组织界面周围未观察到明显的炎症反应,适合体内植入。 骨缺损修复效果:将载有细胞的构建体置SD大鼠的颅骨缺损处,micro-CT、BMD及H&E 染色结果表明Microgel-15%SilMA/GelMA比15%SilMA/GelMA相比,可明显促进BMSCs的增殖和体内骨再生。 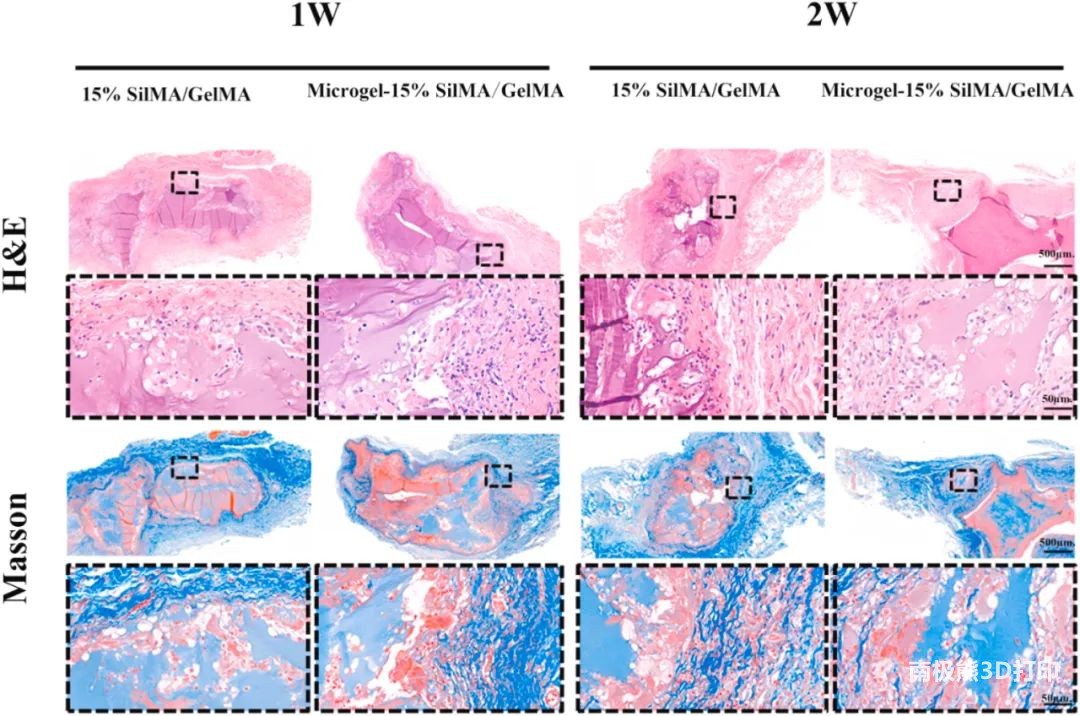
图6 皮下植入3D 打印结构体1周和2周后的H&E 和 Masson 染色
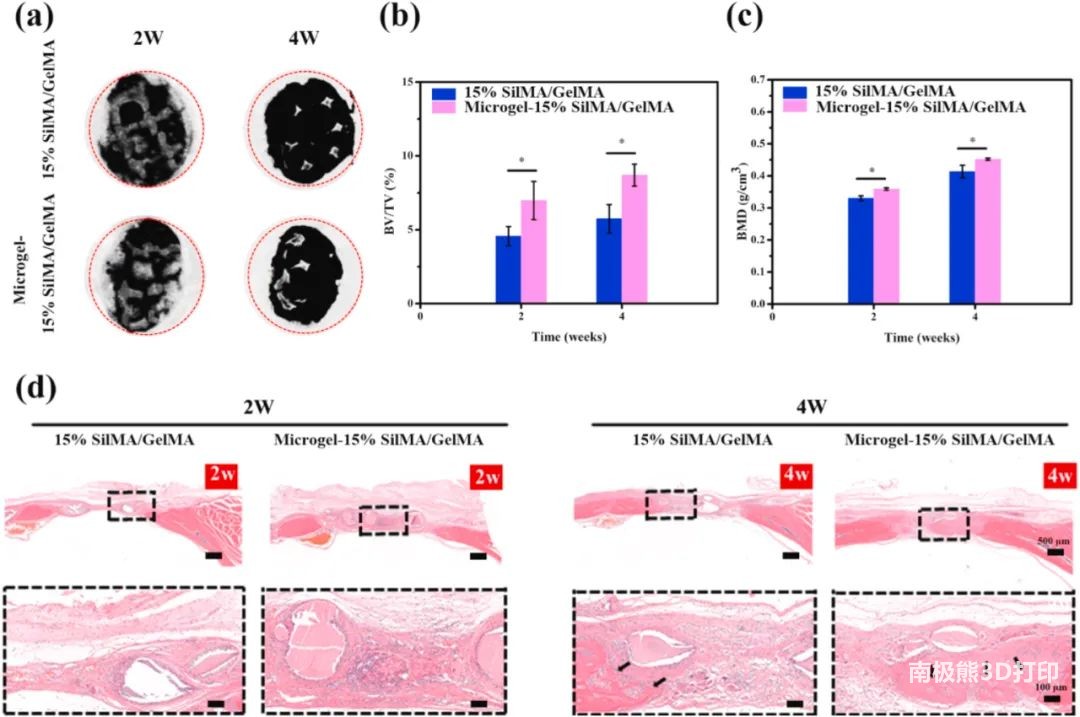
图7 评估体内骨再生图
总之,研究者证明了使用微凝胶封装细胞减少打印过程中的细胞损伤、增强细胞活力策略的可行性。同时表明,嵌入微凝胶的SilMA/GelMA具有良好的生物相容性,具有成为用于3D 生物打印的多功能生物墨水的潜力。 (责任编辑:admin) |