《AHM》:3D打印为患者定制“一对一”个性化siRNA疗法
时间:2023-10-07 16:56 来源:南极熊 作者:EngineeringForLife 点击:次
| 合成的双链小干扰RNA(siRNA)是开发基因沉默治疗的一个潜在候选药物。由于siRNA疗法的药代动力学不佳,其方法的开发和临床转化仍然具有挑战性。3D打印技术为局部和持续传递siRNA制造个性化植入物提供很好的机会。水凝胶可以模拟组织的力学性能,避免与刚性植入物相关的问题。为此,来自德国莱比锡大学的Michaela
Schulz-Siegmund及其团队制备一种适合于挤出3D打印的热响应复合水凝胶,以制造装载siRNA脂质体RNAiMAXTM复合物的控释植入物。本研究选择一种主要由不带电的琼脂糖组成的水凝胶基质来保护siRNA免于解络。此外,添加多个F127和明胶,以提高打印性、降解性和细胞对琼脂糖植入物的粘附。为了避免siRNA在打印过程中暴露于热应力下,为植入物建立了一个核心和壳设计,其中一个siRNA复合物的核心在没有加热的情况下打印,并与一个由热响应复合水凝胶组成的外壳包围。通过改变打印模式来控制siRNA复合物的释放谱。本研究结果显示,植入物可以维持释放siRNA
1个月。本研究证明了释放的siRNA复合物直到第8天依然具有完整性。 相关研究内容以“Fabrication of 3D Printed, Core-and-Shell Implants as Controlled Release Systems for local siRNA Delivery”为题于2023年9月15日发表在《Advanced Healthcare Materials》。 
图1 复合水凝胶的流变学评价
不同成分复合水凝胶的流变图如图1所示。为了设置打印条件,将每个复合水凝胶的溶胶-凝胶转变温度记录为存储和损失模量曲线之间的交叉点(图1A中箭头处)。图1B显示当将形成的凝胶的温度从20℃提高到60℃时,存储模量和损耗模量之间没有交叉。 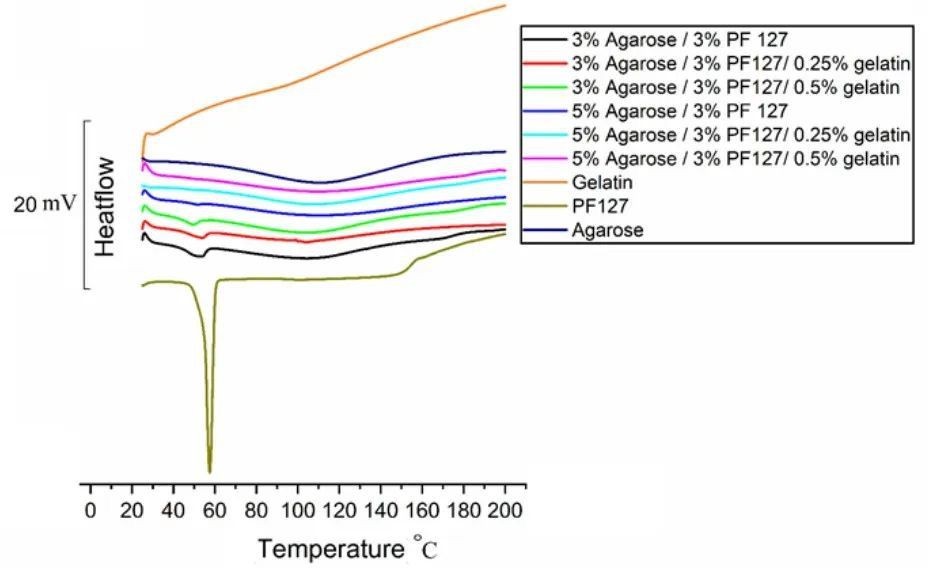
图2 琼脂糖、PF127、明胶和复合水凝胶的差示扫描量热法(DSC)热图
琼脂糖、PF127、明胶和复合水凝胶的热图如图2所示。PF127在57℃处出现一个与其熔化温度对应的吸热尖峰。熔化峰也出现在含有3%琼脂糖的复合水凝胶的所有热图中,表明PF127仍处于结晶状态。在含有5%琼脂糖的复合水凝胶中,没有PF127的熔化峰,表明PF127已经转化为非定形形式,赋予系统更高的灵活性。琼脂糖浓度依赖性的PF127结晶度的降低可能归因于琼脂糖对PF127的塑化,表明两种聚合物之间可能存在分子间相互作用。含5%琼脂糖的复合水凝胶比3%琼脂糖水凝胶更适合打印系统。 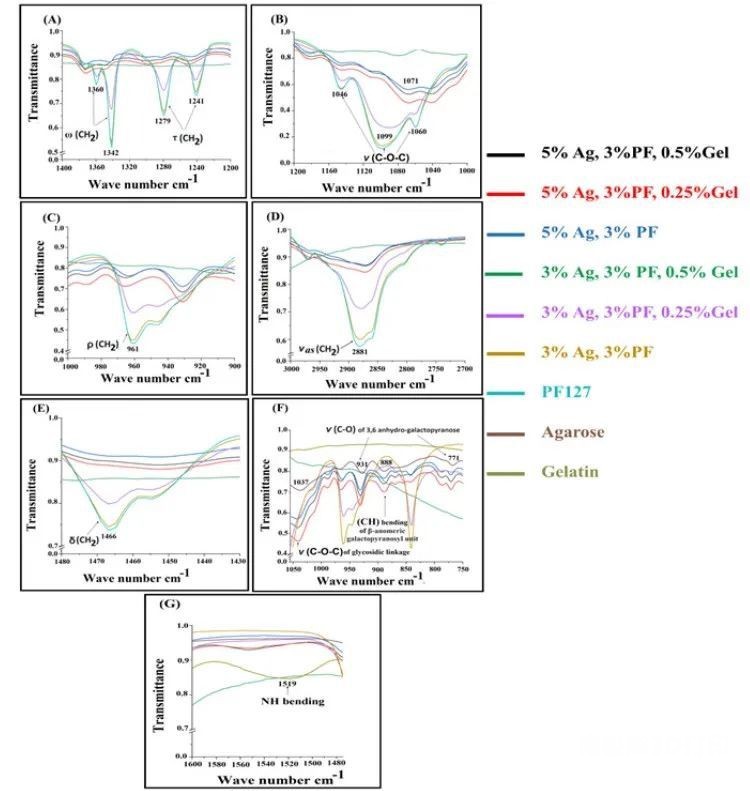
图3 复合水凝胶的FTIR光谱
对于PF127粉末,1342和1360 cm-1处的两个带对应于甲烯组的摆动(ω)振动,1241和1279 cm-1处的两个带对应于扭转振动(图3A)。在1060、1099和1146 cm-1处,C-O-C的拉伸(ν)振动可以视为三个主要条带(图3B)。在961处观察到的峰值对应于甲烯组的摇摆(ρ)(图3C)。在增加琼脂糖浓度或明胶浓度时,甲烯和甲烯剪切(δ)振动的2881(图3D)和1466cm-1(图3E)的消失也证实PF127以水合而非定形的形式存在。在图3F中可以观察到931和771 cm-1处的3,6-无氢半乳糖弯曲带,以及β-半乳糖单元在881 cm-1处的C-H弯曲振动,以及1037 cm-1处的C-O的拉伸振动带。在1519 cm-1处,所有水凝胶复合材料的N-H波段强度均有所下降(图3G),揭示明胶的N-H基团在复合水凝胶中存在相互作用。FTIR结果证实了PF127、明胶和琼脂糖之间的相互作用。 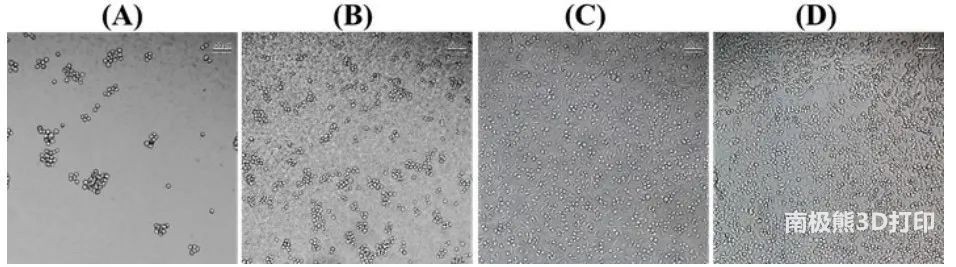
图4 L929细胞生长6天后的情况
本研究在水凝胶配方中加入少量的凝胶(0.25%和0.5% W/W),以提高细胞对琼脂糖/PF127复合水凝胶的粘附性。图4显示在水凝胶上生长的L929成纤维细胞的显微图像,显示L929细胞在含0.5%明胶配制的水凝胶上密度更密集,而在不含或只含0.25%明胶的水凝胶上生长的细胞更少。 
图5 PF127芯墨的可打印性和打印组装好的植入物
在低进料速率下,获得了厚度不均匀的细丝(图5A、B)。图5C描述了30%(w/w)PF127的挤压细丝。此外,荧光标记的AF488siRNA-脂质体RNAiMAX复合物可以均匀地装载在PF127核心墨水中(图5D)。Design2由空间为0.4 mm的5层线,空间为0.8mm的3层线,空间为0.5 mm的2层线组成,排列顺序如图5E所示。Design3和Design4仅制作了6层,但它们的线间距不同,Design3的4层为0.4 mm,2层为0.7 mm,Design4的6层为0.4 mm(图5E)。 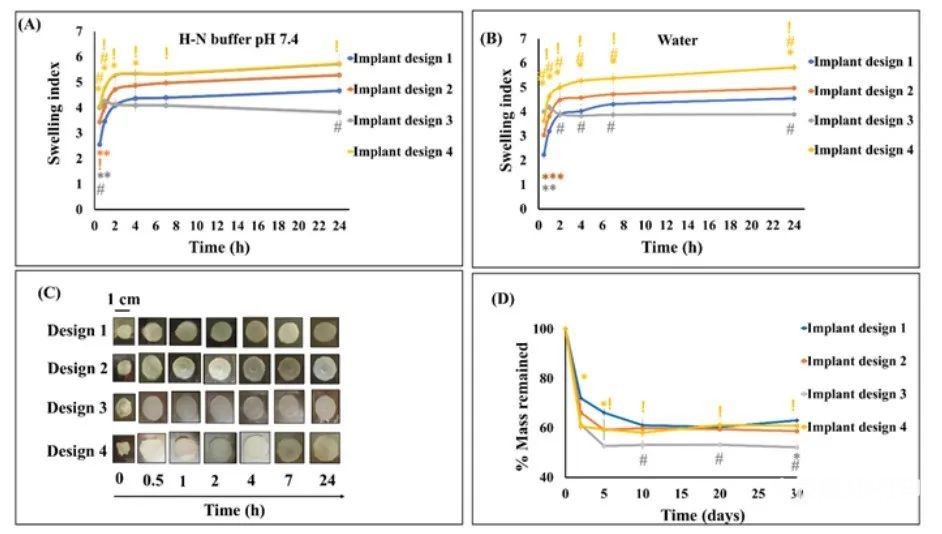
图6 种植体的肿胀指数
图6显示所有的种植体都具有较高的肿胀特性。种植体在缓冲液中的肿胀普遍高于水中。种植体Design3在缓冲液中加入30 min后肿胀指数最高。1h后,种植体Design3的肿胀指数仍显著高于Design1,说明更宽的打印模式和更少层数的Design3促进植入物内水的快速扩散,从而快速膨胀。种植体Design4在所有时间点的肿胀指数均比Design1高,意味着水对10层植入物的侵入需要更长的时间。用H-N缓冲液提取植入体后,植入体Design1、2、3和4的质量百分图如图6D所示,种植体Design3在所有研究设计中质量损失率最高,其次分别是Design4、2和1。 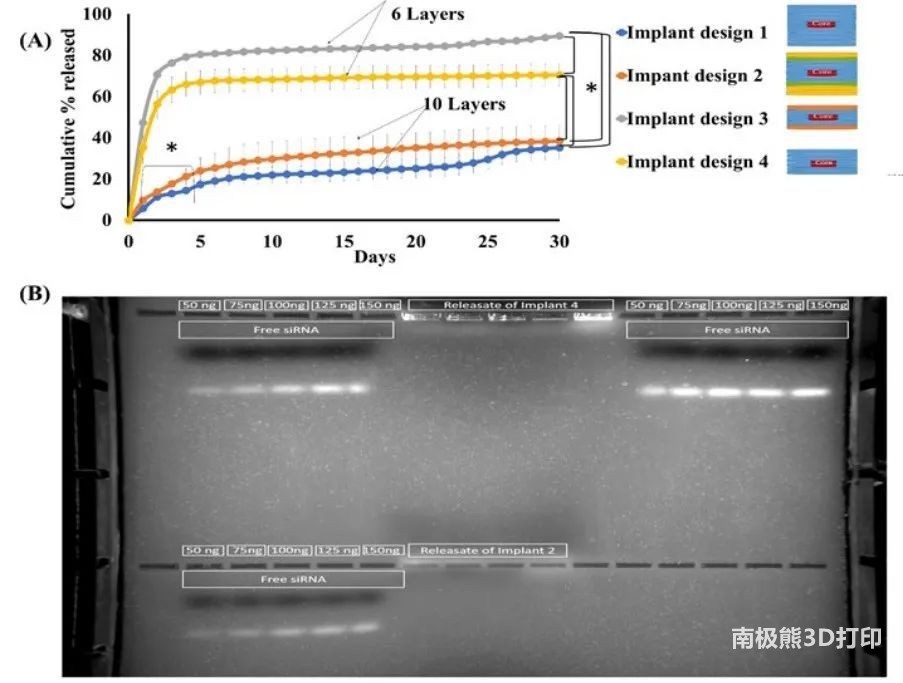
图7 从3D打印植入物中提取siRNA的体外释放研究
siRNA复合物的释放谱如图7a所示,结果显示,3D打印植入物可以成功地维持siRNA复合物的释放超过30天。在Design1、2、4和3中,Design3在30天内累计释放的siRNA%的复合物速度最快。与在凝胶中迁移的游离siRNA样品相比,释放的siRNA样品的条带在琼脂糖凝胶中没有迁移(图7B),表明释放的siRNA样品保持复杂形式,没有检测到游离siRNA。 
图8 琼脂糖环的设计和在细胞活力实验中用于研究从植入物中释放的siRNA复合物的作用的程序示意图
为了研究释放的siRNA是否仍然具有功能,再次测试CD siRNA作为一种模型癌细胞对SAOS-2细胞的影响。本研究开发了一种特殊的细胞培养装置,其中植入物每隔一天从孔移动到孔,而植入物不直接与细胞接触。这是通过一个支持的琼脂糖环来实现的,允许将植入物放置在细胞的上方,因此细胞可以用释放的siRNA复合物来处理(图8)。SAOS-2细胞在与细胞杀伤siRNA植入物孵育后的活力被用来作为释放复合物功能的指示指标。将细胞(3×104)接种于12个孔板中,将200μL 6%琼脂糖溶液铸造在孔壁上形成环,以防止细胞与植入物之间的物理接触(图8)。 
图9 用3D打印植入物 Design 4和Design 2处理后的SAOS-2细胞活力
实验采用Design 4和Design 2的植入物进行。SAOS-2细胞处理后的存活率如图9所示。在植入物Design 4中,在所有时间点,CD siRNA处理的细胞的活力都低于NC siRNA植入物处理的细胞(图9A)。在植入物Design 2中,CD siRNA植入物处理的细胞的存活率似乎都低于NC siRNA植入物处理的细胞(图9B)。 总之,本研究的目的是制造一个3D打印的“核壳”植入物,用于局部传递siRNA。在此提出了3D打印技术作为一种简单的自动制造策略,以提供植入siRNA的治疗。3D打印可以根据每个患者的需要进行定制不同的形状和尺寸。此外,本研究提出了水凝胶复合物作为外壳材料,因为水凝胶植入物比刚性聚合物植入物更有利。用琼脂糖、PF127和明胶制备复合水凝胶,其成分分别为5、3、0.5%。PF127在水凝胶中与琼脂糖基质相互作用,转化为无定形形式。由于明胶含量,水凝胶具有良好的热响应特性,因此被用于3D打印,以制造控释植入物,用于局部个性化siRNA治疗(例如在切除的肿瘤腔内)。利用制备的复合琼脂糖、PF127和明胶水凝胶进行3D打印,打印包含siRNA装载的多核外壳,以赋予植入物的机械强度,并控制siRNA复合物从核心的释放。通过改变植入物设计的打印模式,成功地控制siRNA复合物的释放谱,从而获得更快或持续的释放谱。本研究中的3D打印植入物为个性化siRNA治疗提供了一个很有前景的传递系统。总的来说,本研究提出的3D打印植入物代表一种RNA传递系统,可用于各种疾病的治疗,或作为用于组织工程目的的细胞游离RNA负载系统。 文章来源: https://doi.org/10.1002/adhm.202301643 (责任编辑:admin) |