心脏瓣膜置换术有许多问题,如钙化、炎症和内皮化受限。为此,南京工业大学迟波教授及其团队对以生物可降解的精氨酸修饰的聚赖氨酸和氧化透明质酸为底物,扩大了醛和氨基在生理条件下快速席夫碱反应形成动态酰肼键的优势。这些材料被用于设计动态自适应水凝胶,以及一个模拟细胞外基质的多糖/蛋白质双网络系统,实现了其水凝胶优异的机械可调性和剪切减薄性能。该双重抗菌机制有效地避免了瓣膜植入术后感染样炎症的发生。该水凝胶具有很强的促进细胞增殖的能力,也可以通过一种潜在的细胞招募机制促进细胞迁移。水凝胶在体内动态触发和维持NO的释放,根据需要去除炎症部位高表达的ROS。它进一步促进血管生成,并为氧化应激信号引起的钙化主动脉瓣疾病提供靶向治疗。此外,它具有特殊的抗钙化特性,可以增强CD31的上调,同时抑制IL-10和TNF-α的表达,从而显著促进血管生成,减少炎症反应。此外,3D打印技术还可以对具有不同异构结构的阀门进行个性化定制,以实现高度的仿生组织。
相关研究成果以“ 3D Printed Heart Valve mediated Nitric Oxide Sustained Release reduced potential for calcification and inflammatory Capacity”为题于2023年6月4日发表在《Chemical Engineering Journal》上。
 论文链接: 论文链接:
https://doi.org/10.1016/j.cej.2023.143892
本研究建立了多糖/蛋白质动态自适应水凝胶系统,基于动态化学键和物理动力学的聚赖氨酸和透明质酸实现其特定的生理功能(图1a)。本研究充分利用聚赖氨酸和透明质酸的简单化学修饰,通过精氨酸羧基与聚赖氨酸游离氨基之间的化学酰胺化反应制备功能化聚赖氨酸(PA)和氧化透明质酸(HC)(图1b)。比较精氨酸和聚赖氨酸的核磁共振氢谱数据,可以清楚地看到PA显示出与精氨酸在1.48 ppm、1.60 ppm、3.03pppm和3.61 ppm相似的氢质子信号(图1c)。HC在5.0- 5.5 ppm时也显示出与HA不同的氢质子吸收峰(图1d)。
 图1 功能动态互渗透水凝胶的制备、关键高分子材料的制备及表征 图1 功能动态互渗透水凝胶的制备、关键高分子材料的制备及表征
 图2 功能动态互穿水凝胶的不同交联策略和力学性能的评价 图2 功能动态互穿水凝胶的不同交联策略和力学性能的评价
在制备的活性聚合物的基础上,利用生理条件下醛基和氨基的席夫碱化学反应制备了具有组织适应性特性的动态HAP活水凝胶(图2a)。为了匹配水凝胶支架的机械强度和天然阀门组织,通过引入PEGDA交联剂,形成了一个动态双交联水凝胶互穿网络(图2b),然后分散碳纳米管支架在此基础上产生良好的电传导的水凝胶支架(图2c)。采用应力扫描实验对不同类型水凝胶的力学模量进行了评价(图2d-g)。随着PA和HC聚合物浓度的增加,HAP水凝胶的储能模量呈上升趋势,其频率扫描实验也呈现出相同的趋势(图2h、i)。在互穿小分子PEGDA的存在下,其机械模量呈明显的增加趋势,储能模量约为损失模量的10倍(图2l、m)。同样,导电材料碳纳米管(CNT)的引入也表现出相同的趋势(图2n、o)。由于存在弱动态席夫碱键和互穿的交联网络,因此它具有良好的能量耗散机制(图2r)。虽然添加不同浓度的CNT并没有显著改变水凝胶材料的机械强度(图2s),但由于CNT亲和性的限制,水凝胶网络的能量耗散机制显著降低(图2t)。因此,需要进一步确定碳纳米管的含量,以保持其机械强度而不断裂,同时保持其良好的电转移打印性能。
 图3 功能动态互穿水凝胶的动态适应性、导电性和光热特性的评价 图3 功能动态互穿水凝胶的动态适应性、导电性和光热特性的评价
它具有良好的应力恢复性能(图3a、b),由于席夫碱键在应力条件下的断裂复合(图3c)。在实验中,通过评价水凝胶的电导率后,水凝胶的电导率显著提高(图3d)。紫外-可见光谱证实,随着CNT浓度的增加,水凝胶网络的亲和力显著降低,特别在孵育液中显示为明显的游离CNT(图3f)。此外,溶液的吸光度值也增加了(图3g),随着孵育时间的延长,高浓度CNT的亲和力急剧降低(图3h、i)。CNT在808 nm的红外激光照射下也表现出了良好的光热效应(图3l),随着辐照时间的延长,CNT水凝胶中心点的温度升高(图3j、k)。因此,该导电水凝胶支架的应用将实现血流动力学的多次实时监测,对人工心脏瓣膜的临床应用具有深远的意义。
 图4 功能动态互穿水凝胶的理化结构表征 图4 功能动态互穿水凝胶的理化结构表征
与纯动态交联的HAP水凝胶相比,PEGDA水凝胶具有明显的抗溶胀行为,而CNT水凝胶具有相同的性能(图4a、e)。然而,随着CNT浓度的增加,CNT水凝胶的溶胀率显著增加(图4b、f)。随着体系中PEGDA的引入,水凝胶的交联法增加了共价键的维持,溶胀率从120%下降到60%,降解时间从84小时增加到770小时(图4c、g)。引入不同浓度的CNT后,发现随着CNT浓度的增加,水凝胶体系的稳定性有不同程度的降低,导致其降解时间有显著差异(图4d、h)。通过不同类型的水凝胶支架的显微图像可以看出,纯动态交联的HAP水凝胶呈现出一个层状多孔结构(图4i)。随着PEGDA和CNT的引入,水凝胶的整体孔径变厚,网络结构变密(图4j、k)。此外,激光照射后的CNT水凝胶并不影响水凝胶支架的物理结构(图4l)。因此,这种基于水凝胶的松散多孔支架材料将有助于细胞的存活和分化,促进瓣膜支架的内皮化,提高人工生物瓣膜支架的临床应用。
 图5 功能动态互穿水凝胶的3D打印性能和细胞封装性能 图5 功能动态互穿水凝胶的3D打印性能和细胞封装性能
构建的水凝胶油墨都表现出良好的剪切稀释性能(图5a)。增加的水凝胶交联网络增加了注射压力,但挤压效应没有受到影响(图5b)。随着注入速度的调整,也不受水凝胶油墨的注入压力的影响(图5c)。然后,利用挤出光固化打印机构建心脏瓣膜模型(图5d、f),并成功制备了阀门形状的3D打印样品(图5e、g)。由于醛基和氨基的动态变化,具有剪切稀释特性的水凝胶油墨在膜打印过程中也可以保护细胞免受剪切力的损伤(图5h)。与DMEM相比,水凝胶包封的细胞显示出更高的细胞活力(图5i)和活细胞数量(图5j),这有助于后期构建包含细胞的集成打印策略。
 图6 功能动态互渗水凝胶在体外促进NO产生的评价 图6 功能动态互渗水凝胶在体外促进NO产生的评价
使用精氨酸作为NO释解剂,在体内NO酶的作用下可以产生NO气体(图6a)。与空白对照组相比,实验组的水凝胶显示出较强的颜色变化(图6b)。近300小时后,NO在一个释放周期内实现了持续和稳定的释放(图6c),而NO的饱和释放随着PA浓度的增加而增加,并且随着水凝胶支架结构稳定性的进一步提高,这种优良的NO生成能力并没有相应的变化(图6d)。通过评估整个释放周期中NO的释放速率(图6e),由于水凝胶交联密度和结构稳定性的影响,NO在单一交联动态水凝胶中的释放速率大约是结构稳定的水凝胶的14倍。随着水凝胶的进一步增强,NO在体系中的释放速率显著降低,但没有显著差异(图6f)。与对照组相比,将生物基水凝胶材料与细胞共培养后,水凝胶实验组在细胞中表现出更强的荧光信号(图6g)。通过将水凝胶支架与慢释放NO气体共培养来评估其促血管生成的能力,实验结果证实水凝胶支架具有显著的促血管生成能力(图6h)。
 图7 功能动态互穿水凝胶的体外抗氧化性能的评价 图7 功能动态互穿水凝胶的体外抗氧化性能的评价
水凝胶的抗氧化性能在2小时内迅速增加并达到峰值(图7a),而DPPH的清除作用随着PA浓度的增加而增强(图7b)。溶液的颜色也逐渐褪色和褪色(图7c)。虽然PEGDA和CNT的引入延迟了自由基的清除效率,但它们在12小时内都达到了最大水平(图7d),但没有显著差异(图7e)。在400-700 nm处的全波长扫描也得到了相同的结果(图7f)。同样,本研究制备的水凝胶体系对过氧化氢也有相同的清除作用(图7g-i)。与对照组相比,将生物基水凝胶材料与细胞共培养后,水凝胶组清除活性氧的能力更好,而精氨酸修饰提高了这种能力(图7j)。鉴于该水凝胶材料在ROS清除实验中具有良好的反应性,有望用于主动脉瓣支架的构建,以改善病变的炎症反应,促进瓣膜组织的修复和重建。
 图8 功能动态互穿水凝胶的生物安全性评价 图8 功能动态互穿水凝胶的生物安全性评价
本研究采用CCK-8进行定量、定性检测细胞相容性。结果显示,水凝胶组与对照组相比,具有更高的细胞存活率,保持在110%以上(图8a),形态学特征无明显差异(图8b)。同时,其溶血率较低(图8c)。随着碳纳米管的引入,蛋白质吸附率呈上升趋势,一般保持在10%(图8d),荧光染色显示,与HAP水凝胶组相比,其他实验组FITC的荧光信号明显减弱(图8e),具有抗蛋白粘附能力,有利于减少血栓形成等并发症。
 图9 功能动态互穿水凝胶体外细胞招募能力的评价 图9 功能动态互穿水凝胶体外细胞招募能力的评价
为了模拟心脏瓣膜支架植入对内源性细胞行为的影响因素,采用细胞划痕和跨孔实验进行评价。图9a、b中的划痕试验结果显示,水凝胶组的细胞迁移率整体上高于对照组。利用transwell室构建水凝胶和细胞共培养体系(图9c),发现凝胶组的细胞迁移数量高于对照组(图9d、e),表明该水凝胶支架具有优良的生物学特性,促进NO产生的能力可以促进细胞迁移,将内源性细胞招募到瓣膜部位,加速组织整合和再内皮化。
 图10 抗炎行为 图10 抗炎行为
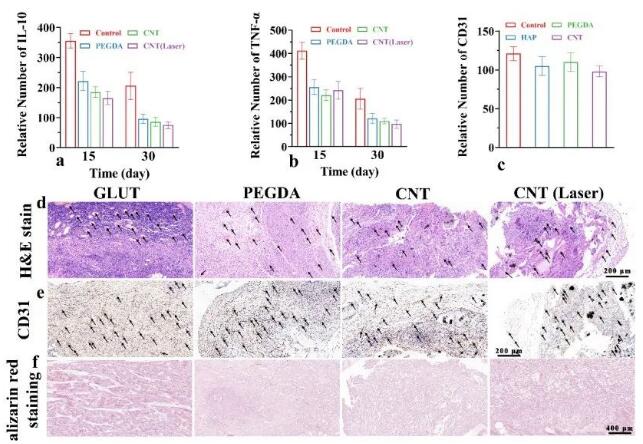 图11 大鼠功能动态互穿水凝胶生理功能的验证 图11 大鼠功能动态互穿水凝胶生理功能的验证
体外实验证实,与巨噬细胞共培养后,与对照组相比,许多巨噬细胞失活(图10a)。随着时间的推移,GLUT组在第30天仍表现出严重的组织炎症,而水凝胶实验组的炎症水平明显下调(图10 b、c)。IL-10和TNF-α抗体的免疫组化染色(图10 d-g)证实,所有植入的材料随着时间的推移都表现出不同程度的炎症下调(图11a、b)。将水凝胶支架植入大鼠皮下组织,然后进行H&E染色(图11c)和CD31免疫组化染色(图11d),显示广泛的血管生成,与GLUT无明显相关性,茜素红染色分析(图11e)显示,GLUT组有大量钙化沉积物,而水凝胶植入物只有少量的沉积物。水凝胶组具有良好的抗炎性和清除ROS的活性,并具有较强的抗钙化潜力,为瓣膜性钙化疾病的预防和治疗提供了一种新的治疗方法。
 © 3D科学谷 © 3D科学谷
综上所述,本研究提供了一种抗菌水凝胶,可以释放NO、去除ROS、促进血管生成,以解决各种术后并发症,如钙化、血栓形成、炎症和有限的再内皮化。本研究采用L-精氨酸功能化的天然抗菌聚合物聚赖氨酸和透明质酸氧化钠形成单一的交联动态交联网络。采用聚乙二醇二丙烯酯构建互渗透双网络系统,实现水凝胶在保持其机械强度的同时发挥生理作用,保证移植后瓣膜的寿命。此外,它还具有优良的剪切减薄特性,并可以通过3D增材制造技术来模拟构建人工心脏瓣膜支架。CNT掺入在808 nm激光照射后与聚赖氨酸产生双重协同抗菌作用,有效避免瓣膜植入后感染和炎症反应的发生。体外生物学实验证实,该水凝胶在促进细胞迁移、抑制炎症细胞增殖、抵抗蛋白粘附等方面具有良好的生物活性。水凝胶可以动态触发体内一氧化氮酶的连续释放,并删除活性氧高表达的炎症部位,参与生物瓣膜的再内皮化,下调炎症因子的表达,直接靶向治疗ROS介导的氧化应激信号减少腔钙化。此外,通过体内植入实验证实了其具有良好的组织适应性、促血管生成和抗钙化能力。然而,由于水凝胶材料、机械强度、降解率、打印工艺等方面的限制,很难构建一个高度模仿天然瓣膜组织的瓣膜支架,但仍需要实现瓣膜组织的个人需求,改善手术结果。其效果具有长期的临床应用意义。
(责任编辑:admin) |