《AM》:无创体内3D生物打印!用于骨折修复
时间:2024-01-31 09:37 来源:EFL生物3D打印与生物制造 作者:admin 点击:次
| 组织工程支架材料为患者的生理保护和治疗提供了必要的支持。不幸的是,这种装置的植入过程带来了手术并发症和感染的风险。因此,来自昆明理工大学的徐旭辉教授团队和成都大学的余雪教授团队合作开发了一种上转换纳米颗粒(UCNPs)辅助的生物3D打印方法,以实现无需侵入性手术的体内成型。合理设计的UCNPs将穿透皮肤组织的近红外(NIR)光子转化为蓝紫光(300-500
nm),在体内诱导单体聚合固化过程,使用熔融沉积建模协调框架,精确预定的近红外激光轨迹可以制造具有定制形状的植入式医疗设备,成功实现了非侵入性骨折固定支架的3D生物打印证明,从而展示了一种全新的生物医学治疗体内成型方法。相关论文“Upconversion
3D Bioprinting for Noninvasive In Vivo
Molding”于2024年01月11日发表于杂志《Advanced Materials》上。 本文提出了一种基于UCNPS辅助聚合过程的非侵入性3D生物打印骨折固定系统,如图1所示。采用3D坐标定位框架固定近红外连续波(CW)激光器,并通过计算机辅助设计3D支架模型来精确控制NIR的移动。将含有UCNPs作为生物链接的单体溶液在体内非侵入性地打印成定制的形状。 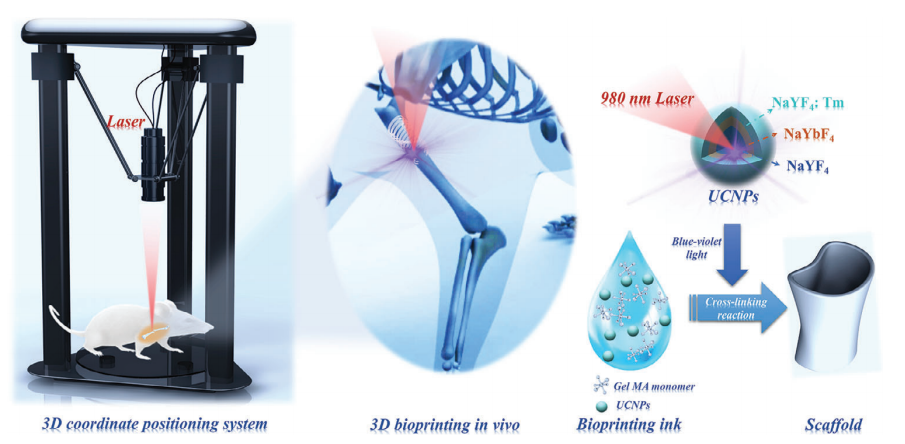 图1 非侵入性固定断骨的UCNPS辅助的3D生物打印体内示意图 本研究中,设计了核壳NaYF4: Tm3+@NaYbF4@NaYF4来调制蓝紫光发射,以实现高效的光聚合。本研究采用热注射法逐层合成了一系Tm3+掺杂浓度为5%NaYF4: Tm3+@NaYF4@NaYF4 UCNPs(图2)。核心材料(NaYF4:Tm3+)的代表性透射电镜(TEM)图像显示单分散的六方颗粒,平均粒径约为≈65 nm(图2a)。利用透射电镜(TEM)和高角度环形暗场扫描透射电镜(HAADF-STEM)对合成的核-壳UCNPs的形貌进行了进一步评价。TEM图像显示,核壳粒子具有均匀分布和单分散性特征,其中中间的NaYF4(图2b)和非活性的NaYF4(图2d)的壳层厚度分别为9.28 nm和13.75 nm。此外,如图2c、e所示的HRTEM图像中,NaYF4: Tm3+@ NaYF4和NaYF4: Tm3+@ NaYF4@ NaYF4对应的快速傅里叶变换模式进一步表明所制备的UCNPs结晶良好。所得样品的XRD谱图及相应结构底部的模拟结果如图2f所示。能量色散X射线(EDX)图谱分析进一步证实了Na、Y、Yb、F和Tm的非均相核壳结构和均匀的元素分布(图2g)。 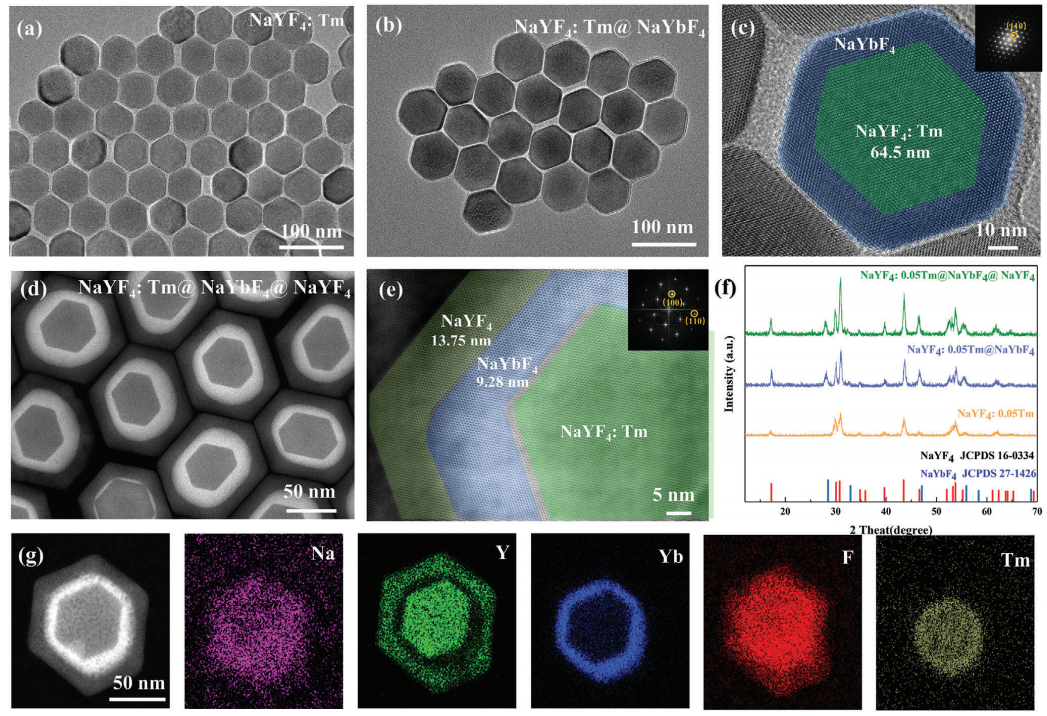 图2 合成UCNPs的微观结构表征 所设计的不同核壳结构的UCNP的发光性能和光固化效果如图3所示。图3a显示了具有相同Tm3+浓度的相应UCNP的光致发光(PL)光谱。此外,通过调节Yb3+离子敏化剂和Tm3+离子激活剂(图3b)的浓度,进一步选择性地优化了相应UCNP的发光性能。还研究了UCNPs在光引发剂吸收范围内的PL性能(图3d)。UCNP的近红外诱导光聚合性能如图3e所示。测定了不同曝光时间和近红外光功率下的光固化比,以评估UCNPs引发剂的效率,如图3f所示。 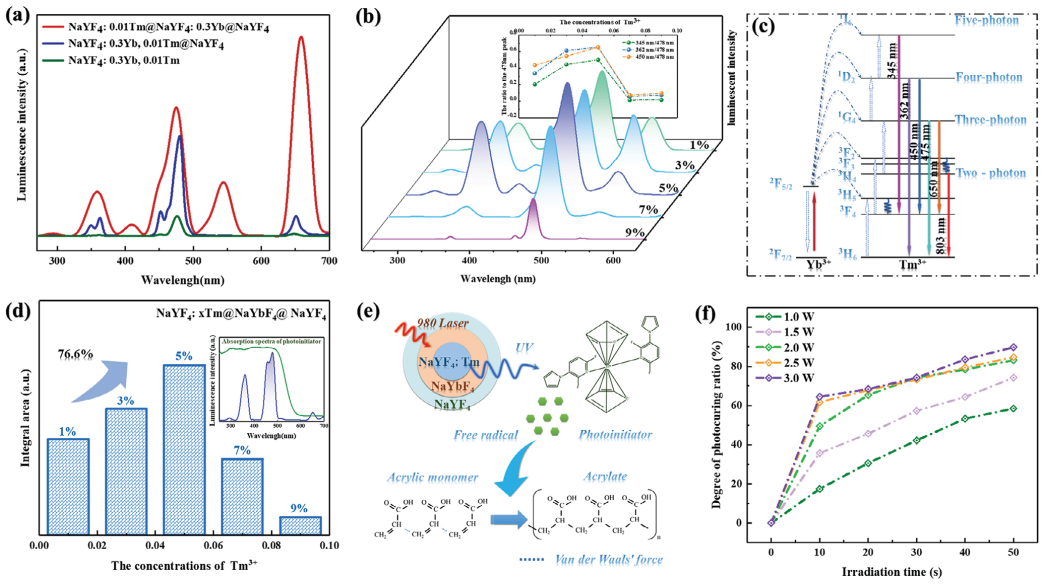 图3 合成的UCNPs样品的PL表征及光固化的评价 采用该方法打印斜交骨折(图4a)、粉碎性骨折(图4b)、T形骨折和横向骨折的不同骨折固定支架。图4a、b中标记为I、II和III的图像分别显示了骨折前、骨折后和3D骨骼固定骨,标记为IV的图像显示了相应支架的放大视图。图4c显示了一只实验大鼠的骨折图像。随后,将生物墨水溶液注射到实验大鼠的骨折部位(图4d)。在计算机控制下,近红外焦点沿着计划的路径移动,以塑造生物墨水溶液(图4e)。支架在体内无创固定在骨折处(图4f)。这表明UCNPS辅助的体内非侵入性NIR 3D生物打印技术具有在原位制备复杂组织用于器官重建的潜力,且医源性损伤最小。 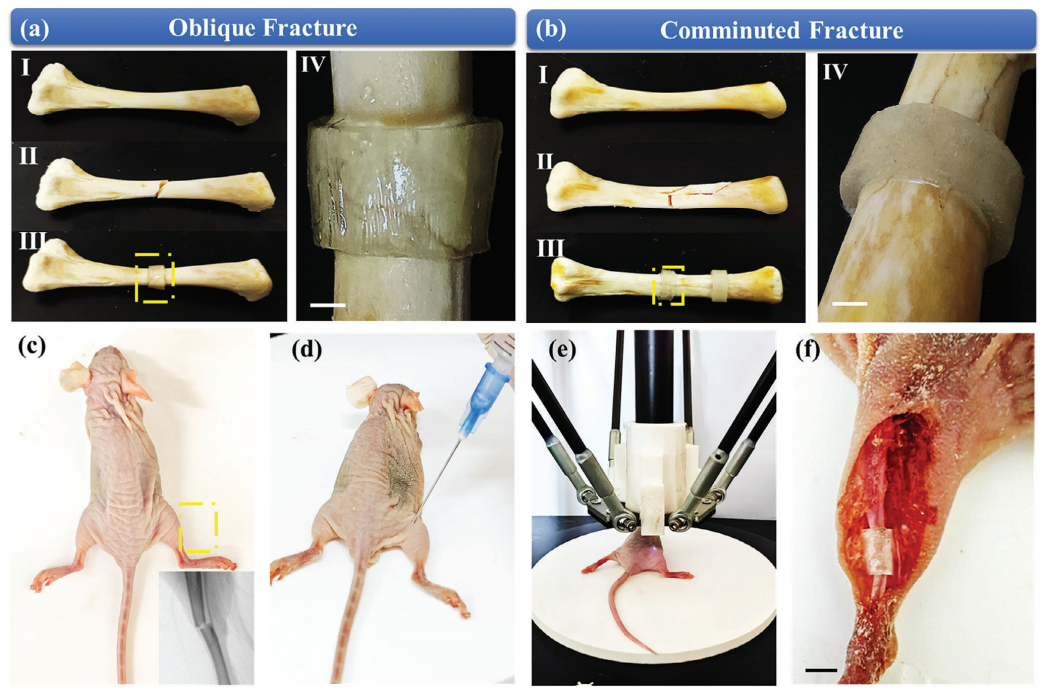 图4 UCNPS辅助三维生物打印技术在骨折内固定中的应用 总之,基于UCNPs辅助的近红外聚合过程,研究团队开发了一种使用配位框架的体内非侵入性3D生物打印成型方法。合理设计了核壳UCNPs,在光引发剂的吸收光谱范围内提供了高效的蓝紫光发射。利用坐标定位框架,为了使近红外激光沿预定的轨迹进行精确的运动,在给定的三维模型的基础上制造物体。因此,定制的支架可以从局部骨折部位皮下注射的生物墨水中无创地在体内打印出来进行骨折修复,显示出在临床或医学研究中的潜在应用。 论文:https://doi.org/10.1002/adma.202310617 (责任编辑:admin) |