清华大学熊卓和张婷教授课题组: 功能性心肌腔室的工程化构建最新进展(2)
时间:2022-01-18 14:41 来源:生物打印再生工程 作者:admin 点击:次
人类心脏中的分层血管系统包括动脉、小动脉、静脉、小静脉和毛细血管,直径跨越几个数量级。除内皮内层和基底膜外层外,微尺度毛细血管还稀疏地被周皮细胞覆盖,而中尺度小动脉和大尺度动脉则被平滑肌细胞以及弹性蛋白和胶原纤维结合。毛细血管在大约200 μm的距离内为实质细胞提供有效的营养和氧气交换,而肌肉动脉和小动脉控制着血液的搏动流动(图4a)。到目前为止,研究人员在工程组织中微血管和中尺度血管的形成方面分别取得了很大进展(图4b-f)。内皮细胞可在载细胞基质中自组装形成微尺度毛细血管,然而它们往往难以在体外灌注并在体内与宿主血管相吻合。生物工程方法可生成数百微米至数毫米的中尺度血管,并与宿主血管结合,然而它们不能有效地将营养物质输送到周围组织。因此,大尺度ECP的长期生存需要在体外形成微、中尺度血管,模拟复杂的多尺度血管。 
图4
克服扩散限制的血管化策略。微尺度毛细血管(b-d)和中尺度血管(e-f)的体外形成是厚心脏组织所必需的;微尺度毛细血管的体外形成依赖于内皮细胞(EC)的自组装,其由血管新生和血管形成驱动(b);微血管取向由拓扑结构重建或力学信号调节(c);通过吸引周皮细胞和提供合适的力学环境促进微血管成熟(d);单层血管的形成是通过在血管细胞存在时产生预先标记的通道或在EC播种后形成的(e);通过同轴打印和扩散诱导凝胶化方法形成多层异质血管(图f)。
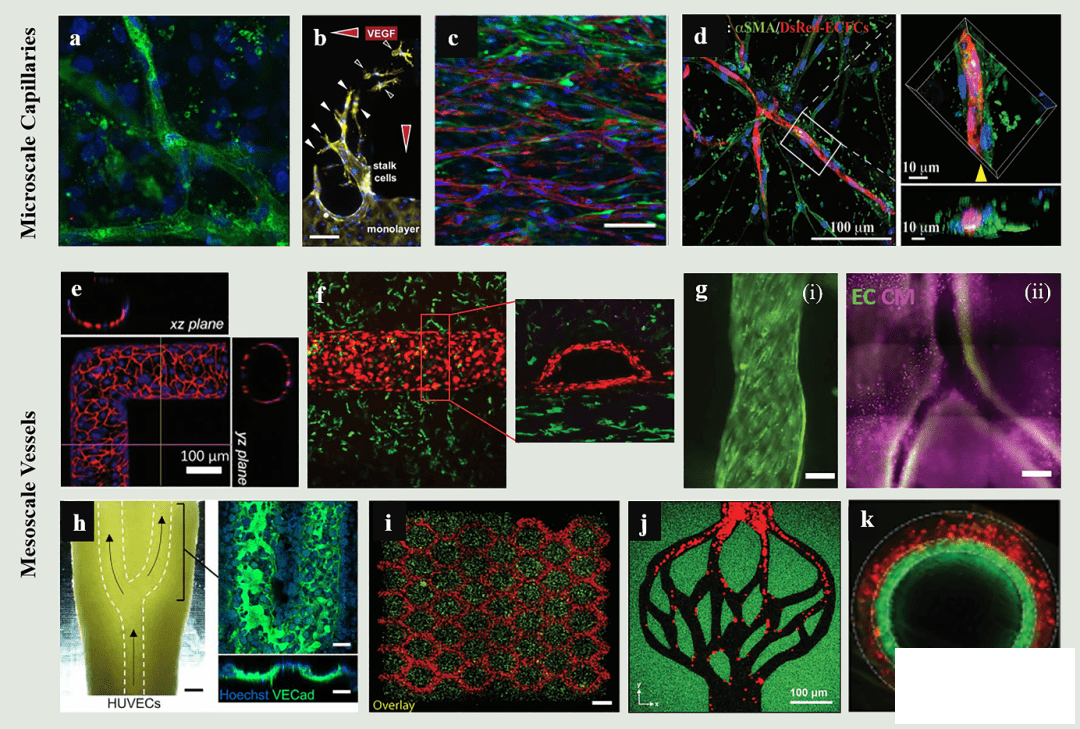
图5
工程化心肌组织中微尺度、中尺度血管构建方法。内皮细胞(EC)能够自组装成微毛细血管结构,由内皮细胞特异性PECAM-A(绿色)和DAPI(蓝色)染色(a);EC在VEGF梯度(红色箭头)下萌发成胶原支架,并用罗丹明-鬼笔环肽(黄色)和DAPI(蓝色)染色。白色和无色箭头分别表示与茎细胞相连和分离的尖端细胞(b);机械约束条件下纤维蛋白凝胶中微毛细管取向,内皮细胞由红色
hCD31标记,转导周皮细胞由绿色荧光蛋白(GFP)标记,细胞核由蓝色Hoescht标记(c);与GelMA水凝胶中的血管周围细胞共培养促进微毛细血管的成熟和稳定。其中内皮细胞由DsRed标记,表达αSMA的平滑肌细胞从间充质干细胞分化而来(d);通过逐层组装具有预先设计拓扑结构重建形状的胶原水凝胶,形成可灌注血管通道。内皮细胞用CD31(红色)和DAPI(蓝色)染色(e);在3D打印的易流变性Pluronic
F127模板上浇铸载细胞水凝胶形成可灌注血管通道,通道内有HUVEC(红色)衬里,周围组织包裹有人类新生儿真皮成纤维细胞(HNDFs,绿色)(f);使用载有EC的牺牲生物墨水3D打印微纤维,通过牺牲打印的方法制造血管化心脏心肌补片,用CD31(绿色)和肌动蛋白(粉红色)染色(g);通过牺牲打印策略形成血管通道,并用HUVECs(绿色)灌注(h);用DMD立体光刻法直接制造血管化组织,HUVEC(红色)封装在通道中,HepG2细胞(绿色)封装在周围组织中(i);利用光切除的方法在荧光素修饰的水凝胶(绿色)中生成仿生血管通道,并用荧光微珠(红色)灌注(j);通过同轴打印策略形成双层血管(图k)。
工程化心肌腔室(ECP)的成熟一方面,虽然微智造技术特别是3D打印技术能够精确控制细胞和生物材料的空间沉积,以创建腔室的拓扑结构重建形状,但工程化心肌腔室不能自动获得天然心脏的功能。工程组织通常需要经过数周或数月的体外培养,通过细胞黏附、组织和基质沉积等方式完成组织形态形成和成熟。另一方面,多能干细胞的出现,包括胚胎干细胞(ESC)和诱导多能干细胞(iPSC),为体外产生心肌细胞(CM)提供了有效的细胞来源,并且具有临床规模的高通量和高纯度。然而,干细胞分化的心肌细胞(PSC-CM)通常是不成熟的,其结构和功能特征类似于胎儿心肌细胞(约第十六周),细胞和组织水平上的不成熟性已经极大地阻碍了其在心肌再生中的应用。例如,PSC-CM衍生的心脏心肌补片由于其独立的、异质性的收缩活动可能改变宿主心肌的电传播,从而导致致命的心律失常风险。迄今为止,通过模拟心脏发育过程中的体内环境,已经开发出多种策略来促进心脏工程组织的功能成熟(图6)。本文回顾了目前工程化心肌组织的成熟策略,并强调了它们在工程化心肌腔室成熟中的潜在作用。虽然目前大多数成熟策略都是通过二维培养模型、微尺度的类器官或心脏构建物来证明的,但这些成熟策略与血管化策略相结合,有潜力在更大尺度上应用于工程化心肌腔室的成熟。 
图6
模拟体内环境的体外成熟策略。在胎儿早期,胚胎心脏长成新月体,之后形成由心肌层和心内膜层组成的心管,两者之间有果冻状的细胞外基质。在胎儿晚期,心管通过折叠和旋转成环,并在冠状血管系统和传导系统开始发育的同时转变为腔室心脏。代谢改变、细胞外基质和非肌细胞相互作用以及机械和电刺激协同作用,促进CM从未成熟胎儿期向完全成熟成人期发育(a);hiPSC心源性分化能够得到成熟程度与早期胎儿CM相当hiPSC-CM。目前已建立了一套促进心脏工程组织体外成熟的生物工程方法,包括长期培养、生化诱导、与非肌细胞共培养、细胞-基质相互作用和生物物理刺激等(b)。
展望与总结 在过去的几年里,具有复杂拓扑结构重建特性的宏观ECP的制备策略和微尺度ECT的成熟策略取得了显著的进展。随着干细胞、生物材料和3D生物打印等技术的快速发展和融合交叉,功能性工程化心肌腔室的体外制造取得了长足的进步,人类有望迎来完整的人工心脏。本篇综述讨论了功能性工程化心肌腔室的一些主要挑战和重要瓶颈,如与制造、血管化和成熟相关的问题。解决这些挑战可以在很大程度上推进心脏修复和心脏疾病的体外建模的技术水平。除了这些瓶颈,其他关键的挑战包括PSC-CM的成本效益和宏观扩展、工程心肌与宿主心肌的电整合、宿主机体的免疫排斥、低温保存和监管障碍等,需要在未来的临床转化中加以解决。 参考文献 本文第一作者为清华大学机械系生物制造中心的博士后方永聪,通讯作者为清华大学机械系生物制造中心的熊卓副教授、张婷副研究员。 Fang Y, Sun W, Zhang T, Xiong Z. Recent advances on bioengineering approaches for fabrication of functional engineered cardiac pumps: A review. Biomaterials 2022;280:121298. https://doi.org/10.1016/j.biomaterials.2021.121298 (责任编辑:admin) |