多孔磷酸钙陶瓷因其优异的生物活性而受到广泛关注。然而,它们较差的机械性能严重限制了它们的临床应用。在保持其生物活性的同时显著提高多孔CaP陶瓷的机械强度仍然是一项重大挑战。
为了解决这个问题,四川大学樊渝江教授/周长春研究员团队在陶瓷烧结过程中使用硫酸钙来调节羟基磷灰石晶粒的定向生长。原位取向晶粒不仅可以缓解应力集中,还可以增强陶瓷晶界之间的结合力。硫酸钙促进磷酸钙陶瓷中活性钙离子的释放,进一步增强其体内生物活性和成骨性。在超临界骨缺损修复模型中,缺损的修复在3个月内完成,机械恢复达到自体骨的70%以上。
相关研究成果以“3D-Printed Bioceramic Scaffolds Reinforced by the In Situ Oriented Growth of Grains for Supercritical Bone Defect Reconstruction”为题于2024年11月13日发表在《Advanced Science》上。
1. 原位晶须增强陶瓷的制备
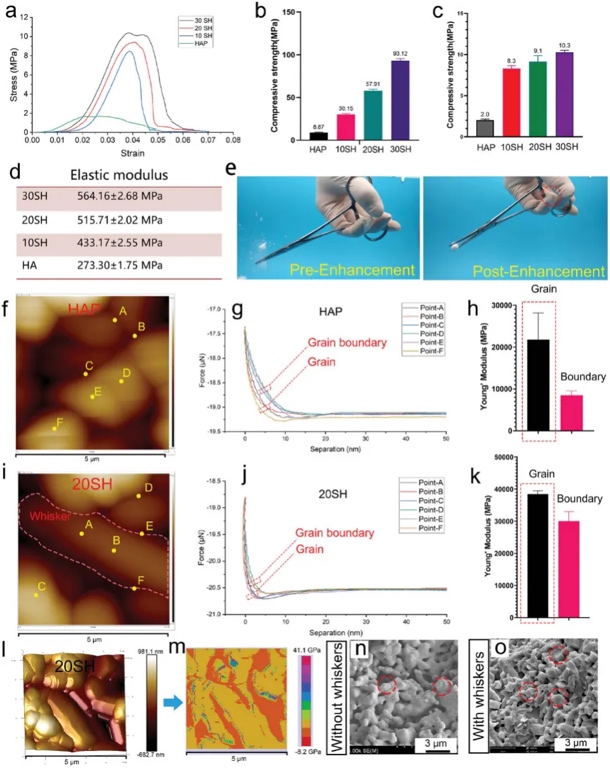
首先,通过DLP技术,利用HAP-CaSO4生物链制备了高精度陶瓷绿色体。在烧结过程中,CaSO4可以调节HAP晶粒的取向生长,形成原位晶须结构(图1a)。制备的多孔陶瓷支架如图1b、c所示,其轮廓清晰,具有多孔结构。研究者制备了含5%、10%、20%和30% CaSO4的3D打印陶瓷绿体。脱粘后,在900 ℃下保存10 h,烧结得到晶须化陶瓷样品(分别为5、10、20和30 SH),其显微组织如图1d-g所示。EDS和XRD表明该材料仅由CaSO4和HAP晶体组成,并确定生成的晶须为HAP(图1h-j)。
图1 原位晶须增强陶瓷(IWRC)的制备
2. 机械性能
为了了解原位晶须结构对陶瓷力学性能的影响,研究者3D打印了孔隙率为68%的固体陶瓷和多孔陶瓷进行了压缩测试(图2a-d)。多孔陶瓷的应力-应变曲线表明,所有支架都表现为脆性断裂,即材料破坏后应力迅速下降。利用原子力显微镜(AFM)进一步研究了材料的纳米力学性能,在原子力显微镜下,HAP和20SH样品在晶粒和晶界上的三个不同点上测量了力-位移曲线(图2f-m)。晶体内的杨氏模量明显高于晶界处的杨氏模量。材料的纳米力学图证实了陶瓷晶粒位置的力大于晶界处的力。断口形貌表明,晶须增强陶瓷具有沿晶和沿晶两种断裂模式,而纯HAP陶瓷仅表现为沿晶断裂(图2n-o)。
图2 机械性能
3. 机械强化机制
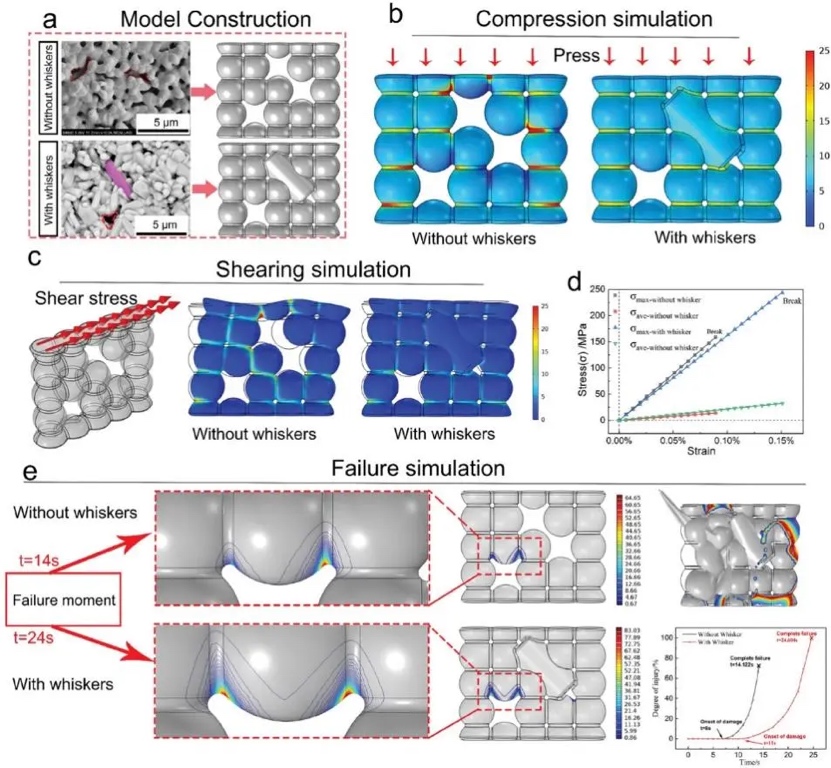
为了进一步了解晶须原位增强的机理,研究者基于陶瓷的微观结构特征设计了二维单层结构的简化模型。将原HAP晶粒简化为球形,将柱状晶须简化为柱状(图3a)。从图3c可以看出,晶须的存在显著提高了支架的变形抗力;应力轮廓图显示,无须支架的微孔中存在明显的应力集中。瞬态模型模拟结果显示,陶瓷基体内的柱状晶须结构有效地缓解了应力集中,延缓了损伤的发生,提高了支架的力学性能(图3e)。
图3 机械强化机制的有限元分析
4. 增殖与分化
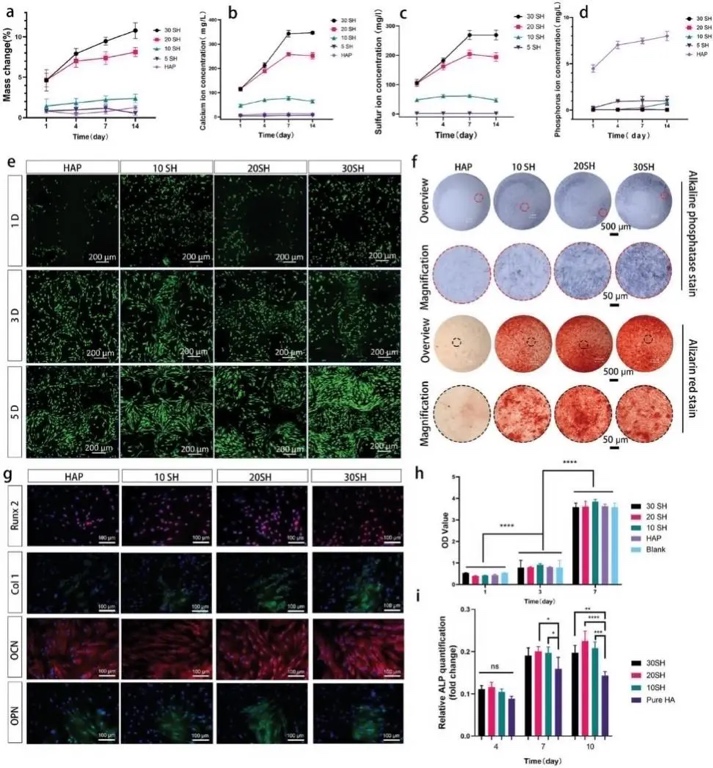
随后,研究者发现IWRC的降解速率与CaSO4的含量成正比,Ca2+的初始释放主要是由CaSO4溶解引起的(图4a-c)。利用骨髓基质细胞(BMSCs)对晶须增强支架和HAP支架进行体外生物相容性评价。结果显示,所有支架上的细胞都有明显的增殖,且添加10% - 30% wt.%的CaSO4不会对干细胞产生细胞毒性作用(图4h)。激光扫描共聚焦显微镜进一步比较了四种陶瓷支架上骨髓间充质干细胞的增殖情况(图4e)。
将BMSCs植入支架进行成骨诱导后,观察IWRC对BMSCs成骨分化的影响。碱性磷酸酶(ALP)染色显示,30 SH和20 SH ALP表达强烈,有利于诱导早期成骨分化;后期骨髓间充质干细胞内的钙结节密度较高(图4f)。通过免疫荧光检测几种成骨相关蛋白,30 SH和20 SH样品的Runx2、Col1、骨钙素(OCN)和骨桥蛋白(OPN)均高度表达(图4g)。
图4 骨髓间充质干细胞3D打印IWRC体外评价
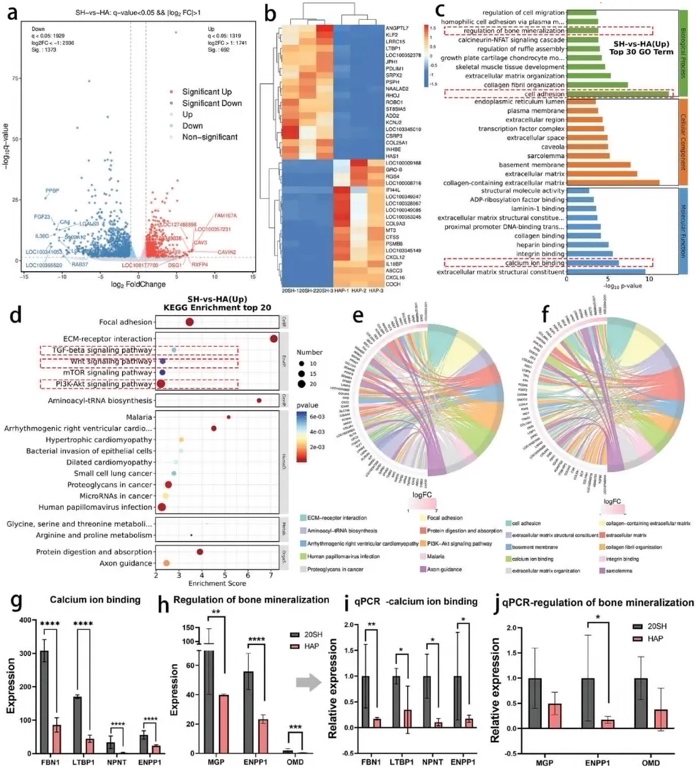
为了进一步研究成骨分化的分子机制,研究者对没有成骨生长因子的情况下,用HAP和20 SH培养21天的骨髓间充质干细胞进行了转录组学分析(图5)。结果表明,PI3K-ART、TGF- beta和Wnt信号通路均被有效激活,其中TGF- beta信号通路富集评分最高,提示其在促进成骨分化中起主导作用。
图5 骨髓间充质干细胞成骨分化的转录组学分析
5. IWRC异位成骨
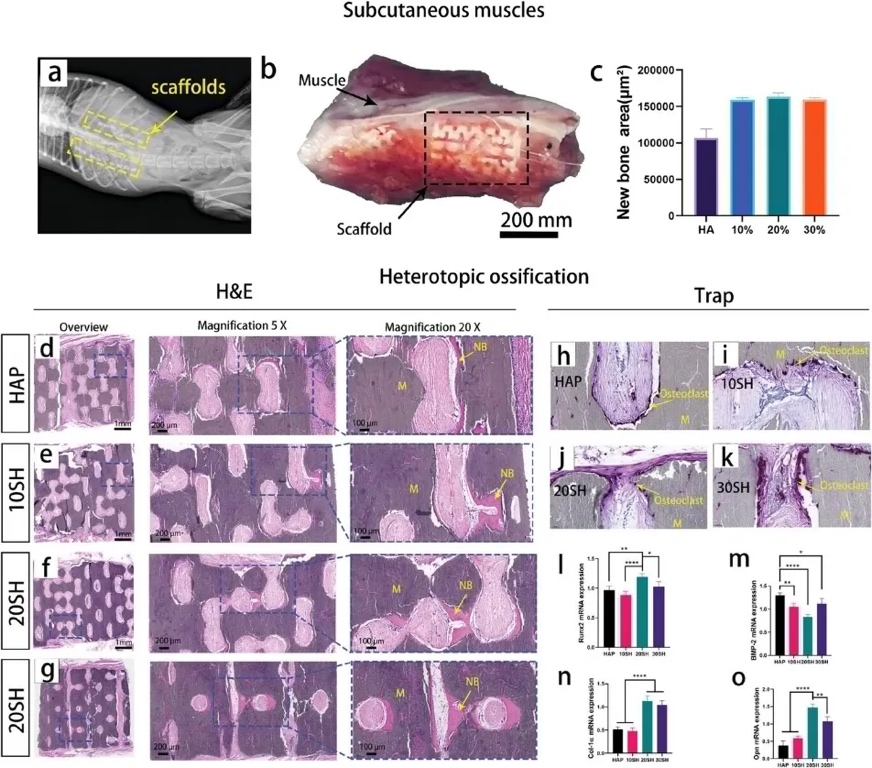
为了评估IWRC的骨修复能力,研究者将四组支架(30 SH、20 SH、10 SH和HAP)植入小猎犬椎旁肌肉3个月,观察成骨现象(图6a)。植入后3个月,材料从肌肉组织中取出。支架与周围肌肉组织紧密结合,组织生长到支架内部,没有纤维包埋的迹象(图6b)。染色组织学分析显示,在20 SH内观察到连续的骨组织(图6e-g)。使用ImageJ软件进行半定量分析显示,晶须增强组的体积明显大于HAP组(图6c)。这表明原位晶须增强陶瓷保留了其骨诱导特性,优于HAP陶瓷,并显示出进一步应用的潜力。抗酒石酸酸性磷酸酶(Trap)染色显示,破骨细胞出现在四组材料中,并紧密粘附在材料表面。这表明诱导的骨组织具有自重塑功能(图6h-k)。聚合酶链反应(PCR)表明,20 SH 组Runx2 mRNA水平和OPN表达均显著高于其他3组(图6l-o)。
图6 体内骨诱导评估
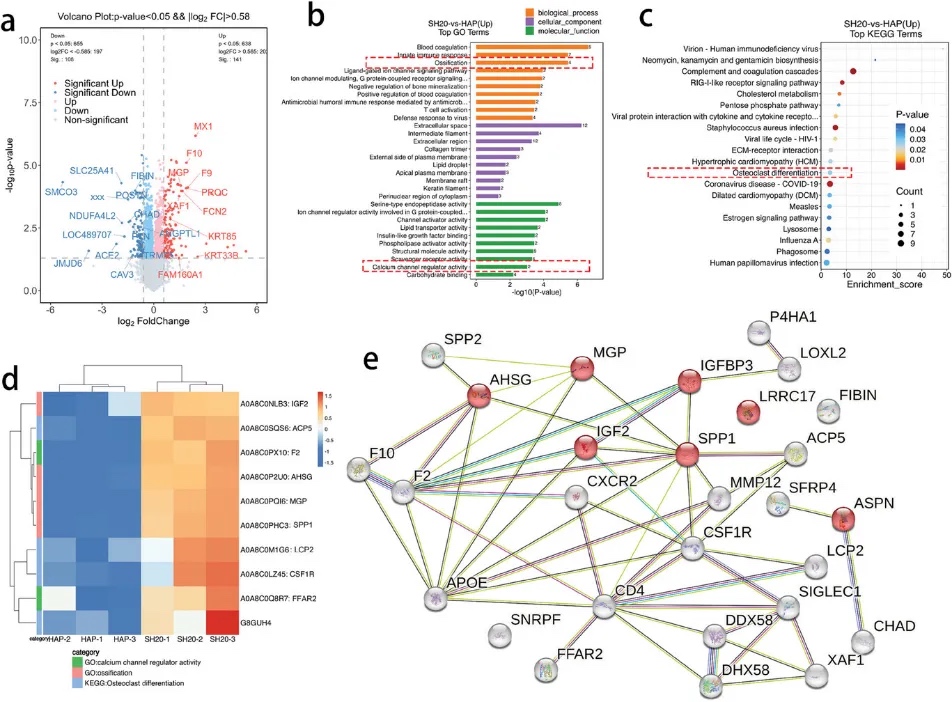
为了进一步阐明IWRC增强成骨能力的机制,研究者在皮下植入支架1个月后对其进行了定量蛋白质组学分析(图7)。结果显示,IWRC可能通过AHSG、ACP5、IGF2、SPP1和MGP等成骨相关蛋白的表达来促进成骨能力。其中,钙离子相关蛋白F2、FFAR2等协同调节成骨相关蛋白的表达。
图7 蛋白质组学定量分析
6.IWRC在超临界骨缺损再生中的作用
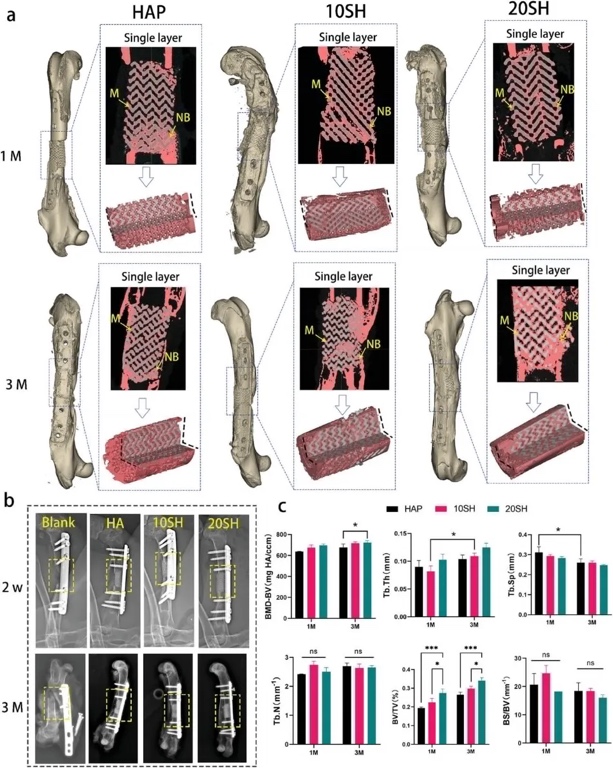
为了评估IWRC促进临床前超临界骨缺损骨再生的能力,研究者建立了15 mm的兔股骨截骨缺损模型。图8a为修复后的3D重建、单层x线片和四分之一剖面图,比较了植入后1个月和3个月支架和股骨的整体形态。从显微CT图像可以清楚地观察到,在10 SH和20 SH组中,新生的骨组织已经融合成连续的结构,支架已经与骨缺损的两端融合。结合半定量分析结果发现,新生骨比例(BV/TV)和新生骨密度(BMD-BV)随骨小梁厚度(Tb.Th)的增加和骨小梁间距(Tb.Sp)的减小而增加。3个月时三组新生骨体积和密度变化趋势与第1个月一致。
图8 IWRC在超临界骨缺损再生中的作用
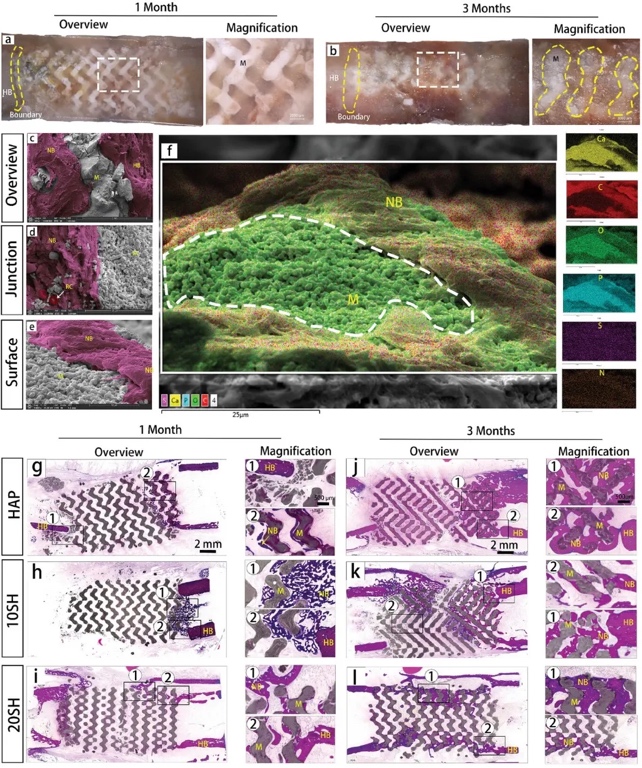
使用光学显微镜观察材料和骨组织的整合。植入后一个月,材料的多孔结构充满了新形成的组织,未检测到纤维包膜(图9a)。植入后3个月,材料和骨组织紧密结合,它们之间的边界完全模糊。支架内新形成的组织的颜色和形态与宿主骨骼的颜色和形态非常相似(图9b)。如图9c-e所示,新的骨组织紧紧包裹着支架材料,新组织沿着陶瓷颗粒的表面增殖,证实了IWRC的生物相容性和生物活性。染色结果显示,植入后1个月,缺损开始逐渐愈合,支架已与宿主骨部分融合(9g-i)。植入后三个月,20 SH组的支架结构清晰,两端与宿主骨完全融合(图9j-l)。新骨组织沿外缘几乎跨越了整个支架,组织的方向接近宿主皮质骨的方向。新骨组织致密,类似于宿主的皮质骨,在新骨内发现大量Haversian管,表明骨组织成熟。
图9 新骨组织的形态
综上,本文使用CaSO4/HAP陶瓷浆料打印高精度多孔陶瓷支架,随后在烧结过程中控制晶粒取向生长,以实现机械增强的晶粒排列结构。CaSO4可以促进IWRC陶瓷中活性Ca2+的释放,显著提高HAP的骨诱导能力。转录组学和蛋白质组学结果表明,IWRC可以激活钙离子通路和成骨相关蛋白的表达。在临床前动物实验中,IWRC仅用3个月就实现了对超临界骨缺损的修复,机械修复率超过了自体骨的70%。本研究协调了多孔陶瓷的生物活性和机械强度之间的矛盾,成功实现了CaP陶瓷生物活性和机械强度的双重优化。
文章来源:
https://doi.org/10.1002/advs.202408459
(责任编辑:admin) |