基于3D生物打印的胆管癌芯片在药物筛选中的应用
时间:2023-04-08 09:58 来源:生物设计与制造BDM 作者:admin 点击:次
本研究论文聚焦基于3D生物打印的胆管癌芯片在药物筛选中的应用。胆管癌(CCA)因为高异质性、低生存率,迫切需要开发有效的治疗药物。然而,现有的CCA药筛模型通常无效,也是至今临床上未有针对胆管癌有效药物的重要原因。为此,作者基于牺牲打印和3D生物打印,构建了仿生CCA芯片模型:将胆管细胞、肝细胞和血管内皮细胞用于模型的3D生物打印,从而实现高度的空间和管状微结构模拟,该模型在很大程度上类似于肝实质-血管-胆道系统的多细胞微环境和解剖微结构(图1),以进行高效的抗肿瘤药物筛选。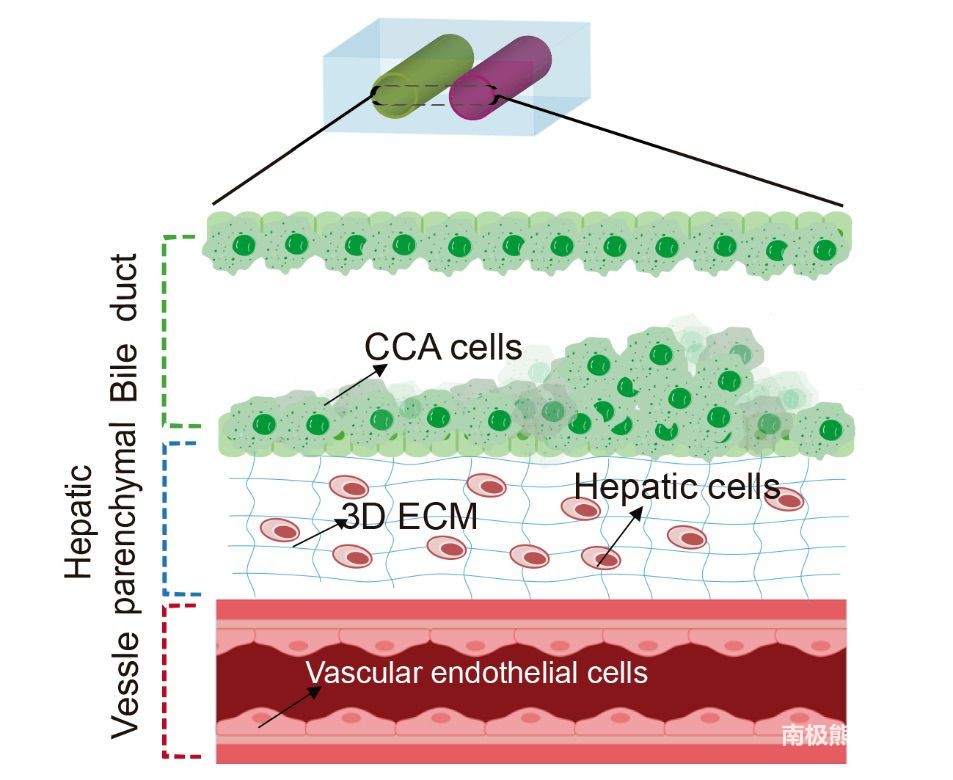
图1 肝实质-血管-胆道系统的多细胞微环境与微结构
CCA是肝脏的原发性肿瘤,主要发生在肝外胆管腔内;60%-70%位于肝门周围区域,约25%位于远端导管,其余位于肝脏(图2a)。胆管细胞、肝细胞和血管在解剖学上有着非常密切的关系,并且通常被确定参与胆管疾病的病理生理学(图2b)。由于该疾病的复杂性,以及需要更好的体外模型来阐明CCA的发生、进展和药物筛选,文中作者提出的CCA模型从单层2D单培养改进为精心设计的、基于3D生物打印的3D共培养芯片模型,该模型由模拟细胞外基质的水凝胶和胆管细胞、肝细胞和血管内皮细胞组成的微环境构成(图2c-i-iii)。 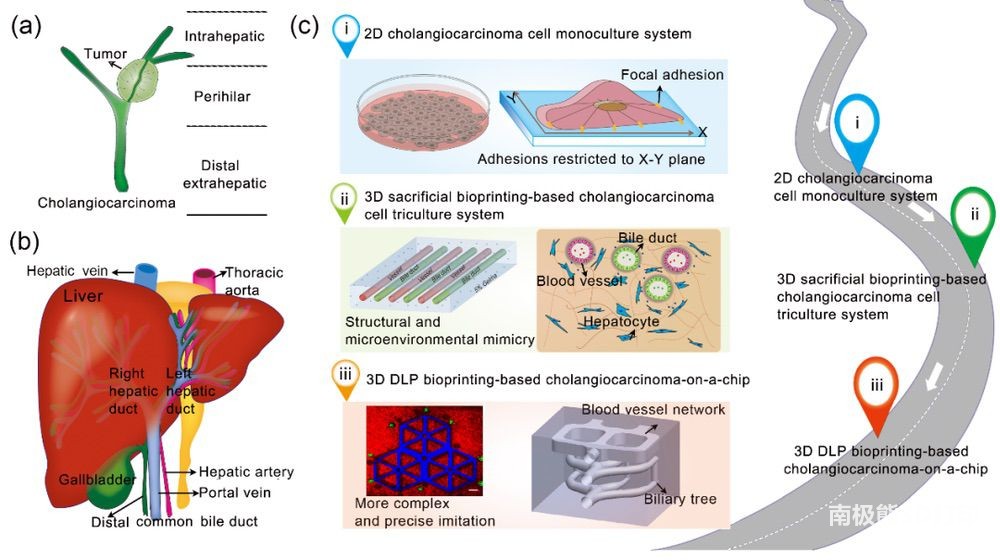
图2 胆管癌芯片设计概况图
作者首先利用牺牲打印,构建了3D 肝实质-血管-胆道多细胞芯片(图3a,b),并证明了3种细胞可以在共培养体系中保持细胞活性(图3c,d)。更有意义的是,当培养9天时,在CCA芯片模型中观察到RBE细胞的以局部增厚的方式过度生长,产生与体内类似的胆管狭窄(图3f),这意味着这些模型的微观结构和微环境有利于CCA细胞仿生生长和肿瘤增生,而传统的2D培养无法模拟这一特殊增殖现象。 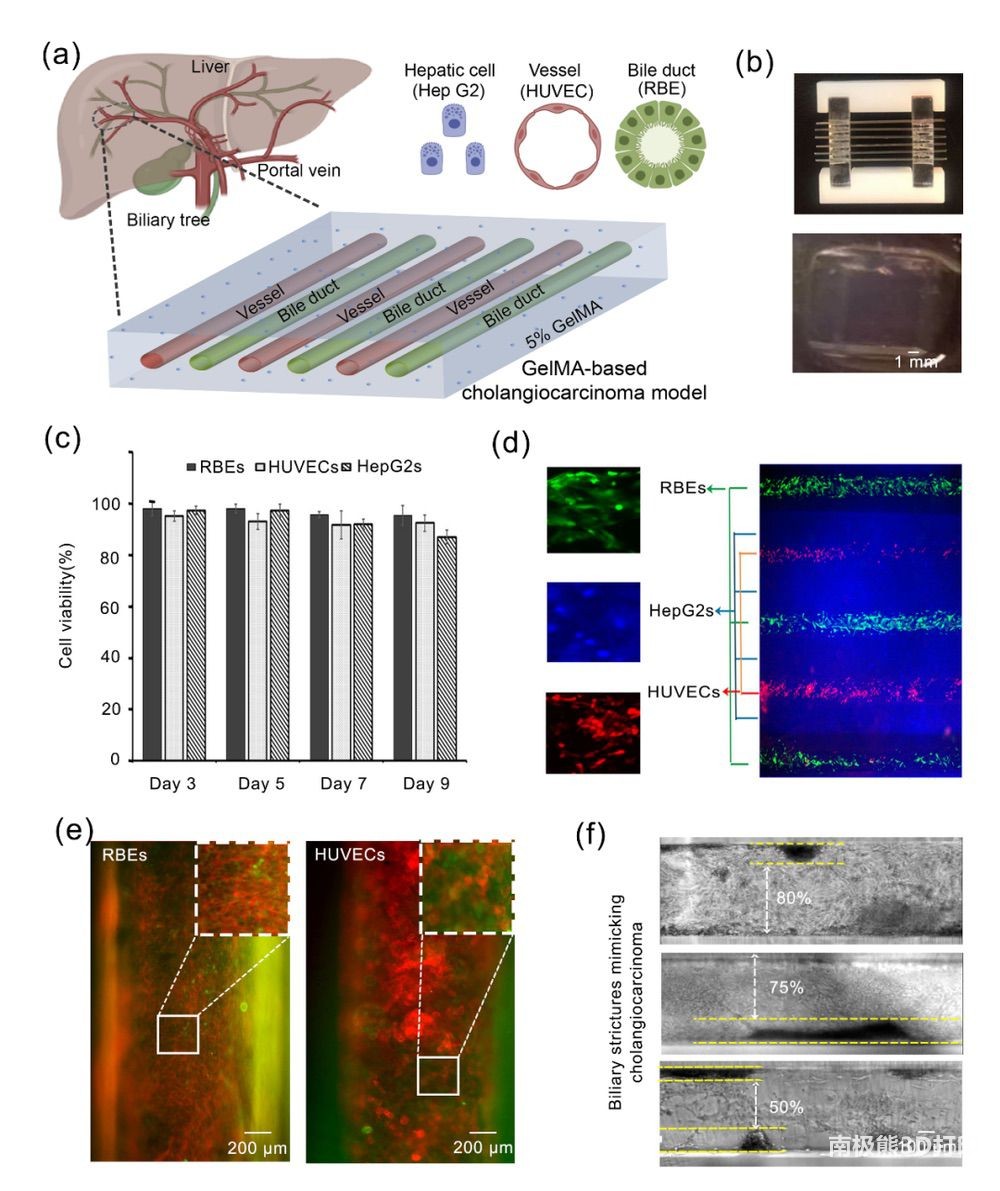
图3 肝实质-血管-胆道多细胞胆管癌芯片设计、表征与评价
为了进一步验证3D 肝实质-血管-胆道多细胞芯片的药筛用途,作者分别将环磷酰胺(Cyclophosphamide,CTX)作用于2D和3D CCA芯片,CTX是进入人体内被肝脏或肿瘤内存在的过量的磷酰胺酶或磷酸酶水解,变为活化作用型的磷酰胺氮芥而起作用的氮芥类衍生物。CTX在体外无活性,主要通过肝脏P450酶水解成醛磷酰胺再运转到组织中形成磷酰胺氮芥而发挥作用。结果证明,CTX对2D培养的胆管癌细胞无显著毒性,而作用于肝实质-血管-胆道多细胞CCA芯片的CTX,显示了剂量依赖的毒性作用(图4c)。以上结果说明了芯片中肝细胞提供了P450对抗肿瘤前药CTX的转化作用,验证了CCA芯片对抗肿瘤新药研发的优势性。 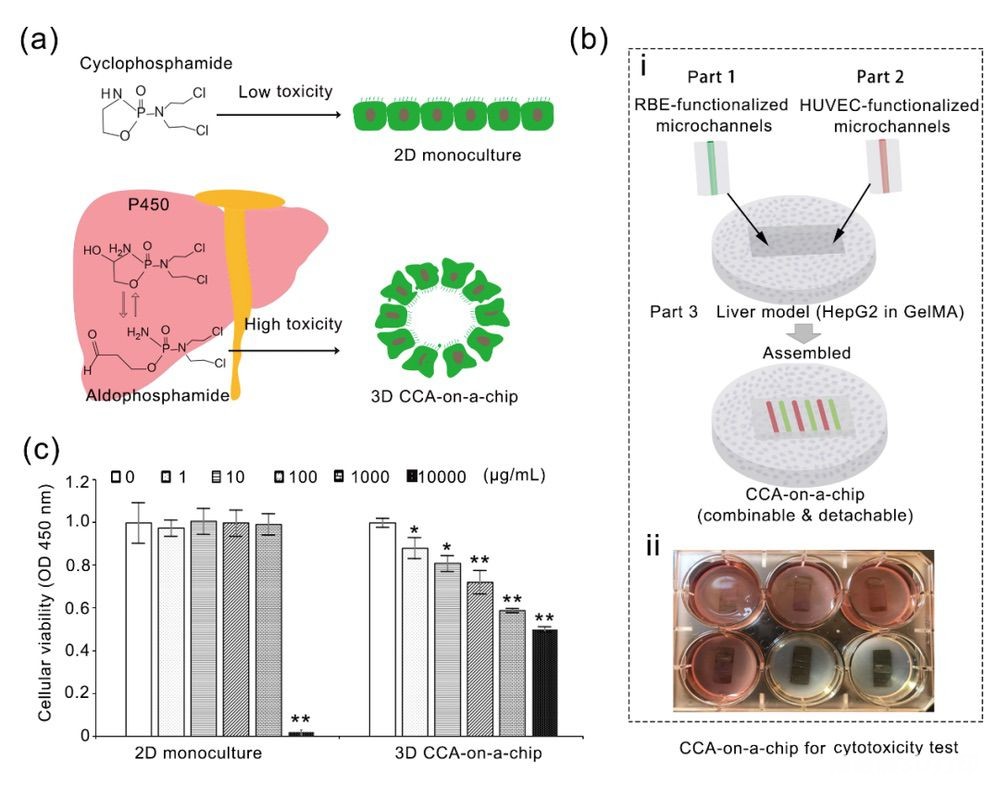
图4 基于2D单细胞培养和3D胆管癌芯片模型的抗肿瘤药物筛选应用
基于DLP的3D生物打印能够快速选择性地固化生物墨水,可根据具体设计实现交联3D结构,该结构包含比牺牲生物打印更复杂的结构。作者利用该技术打印了系列胆管癌芯片,具备以下特殊结构:1. 肝细胞-血管内皮细胞-胆管癌细胞工作的肝小叶结构(图5a,b);2. 模拟肝脏中双血供的血管微通道的空间解剖结构+模拟胆管树的双层分支导胆管结构(图5c);3. 互相交错的血管-胆管结构(图5d)。模块尺寸为6 mm×6 mm,厚度为5 mm。微通道的直径小至200–500 μm(图5e)。随后的灌注进一步证实了这些微通道的相互连接(图5f)。这些模型表明,其与天然CCA的复杂结构(传入血管和胆管穿过肝脏)的相似性得到了改善,并将成为未来CCA研究和筛选治疗方法的合适工具。 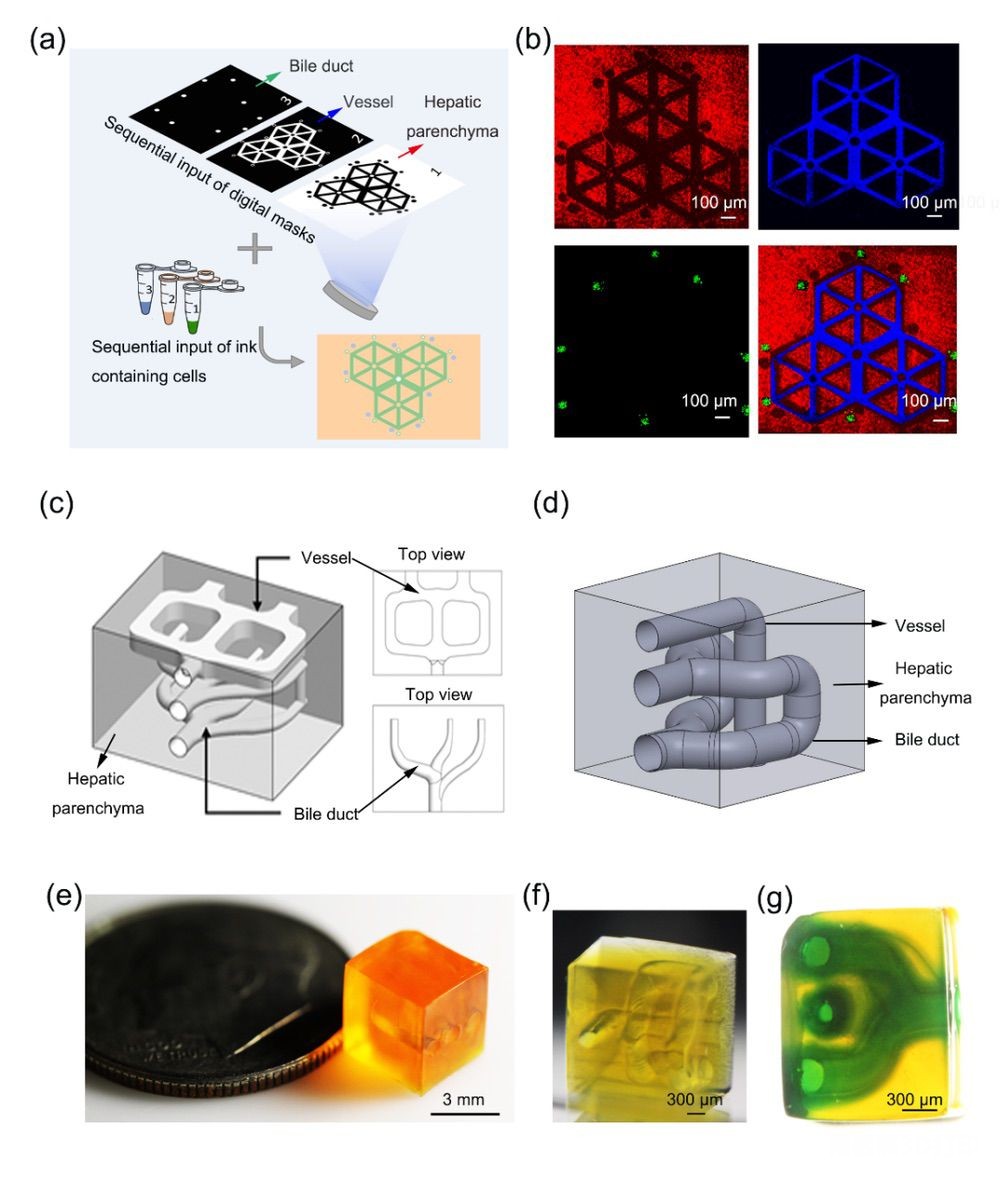
图5 基于DLP 3D生物打印技术的结构复杂的仿生CCA芯片
综上所述,该文通过牺牲或基于DLP的生物打印创建了一系列3D CCA芯片三培养模型,这些模型被证明在很大程度上模拟了天然CCA微环境与微结构,该模型代表了一种潜在的胆管癌新药研发和个性化抗胆管癌药物筛选方法。该文的第一作者为上海市麻醉与脑功能调控重点实验室、同济医学院脑功能与人工智能转化研究所、同济大学附属第四人民医院研究员刘琼,哈佛医学院Y. Shrike Zhang为通讯作者。 (责任编辑:admin) |