苏州大学《Science Advances》:3D打印螺旋管状纤维素支架
时间:2024-09-12 09:56 来源: EngineeringForLife 作者:admin 点击:次
| 肠道微生物群与人类健康以及各种疾病的发生和发展密切相关,例如肥胖症、神经疾病、肠道炎症、外源性过敏,甚至癌症。调节肠道微生物群,也称为微生物群疗法,是一个新兴的医学研究领域,有潜力治疗各种健康状况,并涉及故意改变肠道微生物群的组成和功能。将特定菌株的益生菌或有益细菌引入肠道微生物群,是一种有前途的临床调节肠道微生物群的方法。然而,口服益生菌通常对肠道微生物群和整体健康益处的影响是暂时的或有限的。首先,许多益生菌株对胃酸和胆汁酸敏感。此外,肠道微生物群的组成可以影响接受口服益生菌个体的生存。一个被破坏的微生物群或炎症性肠道条件可能无法为益生菌的定植提供理想的环境。最后,个体的整体健康,如免疫系统受损或某些医疗条件,可以显著影响益生菌的生存和有效性。因此,如何实现足够的肠道递送以及益生菌在肠道中的长期保留和定植对于口服益生菌疗法至关重要。 来自苏州大学的汪超团队开发了一个3D打印的纤维素衍生螺旋管状支架,它能够高效地实现益生菌的口服递送。得益于其独特的表面图案,该系统可以有效地延长装载的益生菌在肠道中的保留时间,而不侵犯附近的组织,为装载的益生菌的生存和长期定植提供有利的环境,并在降解后作为膳食纤维影响肠道生态系统。本文展示了装载Roseburia intestinalis的支架在调节肠道微生物群方面产生显著影响,以治疗各种与肠道相关的疾病,包括肥胖症和炎症性肠病;因此,本文提供了一个通用的平台,用于益生菌的口服递送。相关工作以题为“3D printed spiral tube–like cellulose scaffold for oral delivery of probiotics”的文章发表在2024年08月23日的顶级期刊《Science Advances》。 
1.创新型研究内容 本文报告了一个3D打印的纤维素衍生螺旋管支架,它能够实现益生菌的口服递送,并为益生菌在肠道中的长期保留和定植提供了理想环境(图1)。生物打印技术涉及制造特殊结构,这些结构在生物医学领域被广泛使用。得益于3D打印的独特表面图案,它可以有效地延长在肠道中的保留时间,而不侵犯附近的组织。此外,使用纤维素作为生物墨水可以通过提供有利的环境来保护益生菌免受胃酸和胆汁盐的侵害,支持益生菌的生存和增殖作为有机燃料,并作为膳食纤维影响肠道生态系统,所有这些都使得长期作用对调节肠道微生物群以治疗各种与肠道相关的疾病产生了显著影响。 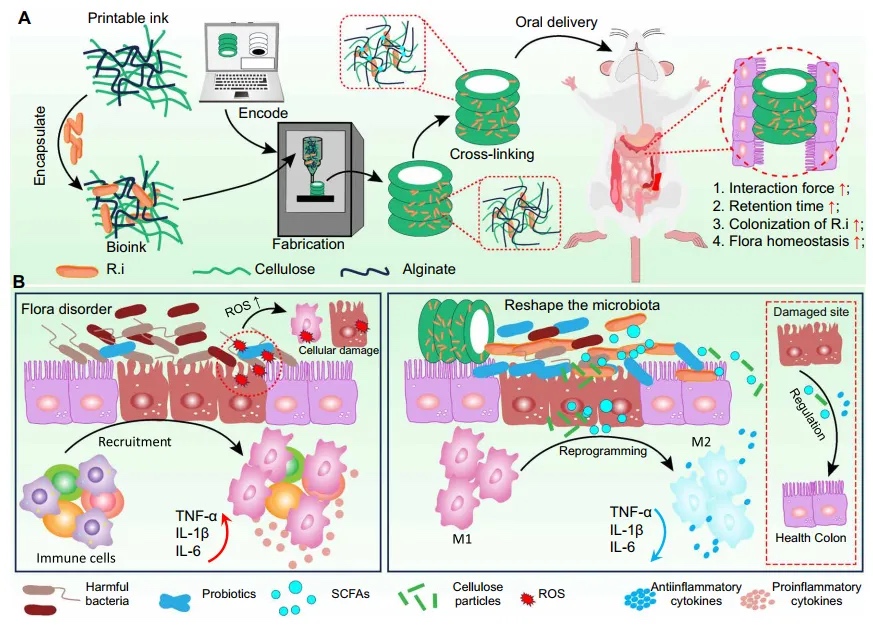
图1 3D打印纤维素螺旋管口服递送益生菌的示意图
【3D支架的独特结构】 表面图案在确定两个相互作用表面的摩擦特性方面起着显著的作用。某些表面处理,如添加微槽,可以用于故意改变各种应用中材料的摩擦性质。然后,本文研究了具有不同环的圆柱形3D支架与肠上皮细胞的相互作用(图2A和B)。环的微观结构可以在扫描电子显微镜(SEM)下快速制造,孔隙结构约为12μm(图2C),这对于进一步的细菌装载和维持益生菌的生存是理想的(图2D)。环的数量可以影响这些管子在肠道中的摩擦力,而当管子有四个环时(每个环长度为1.5毫米),摩擦力最大(图2E)。这一发现有几种解释。首先,一个6毫米长的管子,其表面有四个环,可能与肠道表面接触的表面积更大。其次,环的深度和间距也可以影响表面的粗糙度。第三,环的数量可能会增加法向力,反过来又会增加摩擦力。这个复杂系统的计算建模结果与实验结果一致(图2F和G),这强烈支持了表面图案可以增强肠道中的粘附和保留效果的观点。同时,具有四个环的3D管在结构上也更稳定,与其他管子相比,显示出最佳的抗压应力和压缩模量(图2H和I)。此外,3D支架的孔隙率和含水量在制造过程后没有受到显著影响。 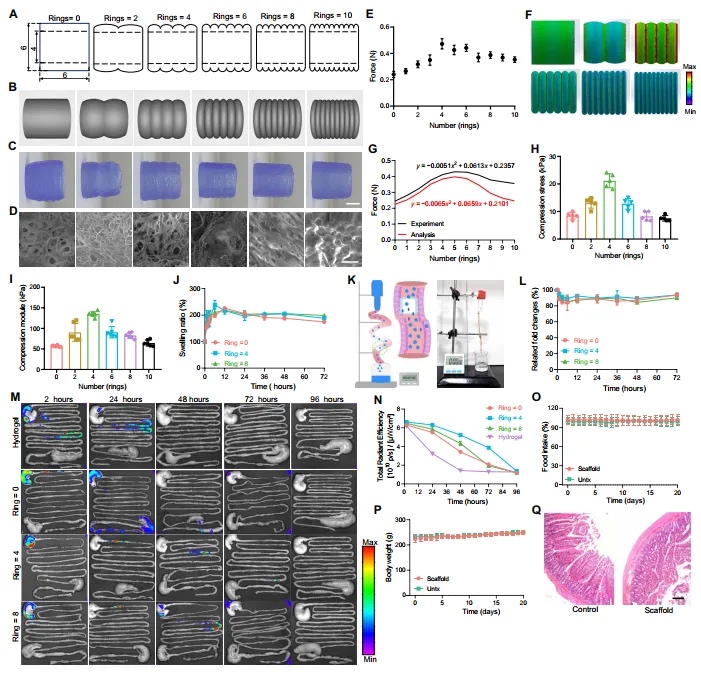
图2 3D打印支架的结构及相关性质
【3D支架中的益生菌装载量】 鉴于3D管在肠道内的优异体内保留能力,本文进一步探索了它们作为益生菌口服递送平台的潜力。Roseburia intestinalis (R.i) 是人类和动物肠道中的一种益生菌,可以通过产生短链脂肪酸(SCFAs)作为代谢副产品来参与调节肠道炎症。通过将R.i(图S7,A和B)封装在HMC-海藻酸钠墨水中,本文在室温下打印了一个装载益生菌的支架管(3D Sca@R.i)(图3A),每个3D支架中加载了108个集落形成单位(CFU)的益生菌。扫描电子显微镜(SEM)显示支架微结构内正常的杆状R.i(图3B)。然后,荧光标记的R.i也可以在3D支架中被检测到,确认了益生菌的成功封装。同时,不同的3D支架的形态结构和相关物理性质在装载益生菌后没有改变。与游离的R.i相比,3D支架管中的R.i增殖活性略有变化(图3C)。此外,3D支架可以在胃酸或胆汁盐的作用下维持装载的益生菌的活性(图3D和E)。这可能是因为打印墨水相对抵抗胃酸和胆汁盐的腐蚀作用,为装载的益生菌提供了保护性覆盖。 【R.i在肠道中的定植和保留】 口服益生菌通常对肠道微生物群的影响是暂时的,因为口服益生菌在肠道中的保留时间暂时无法满足需求。由于其独特的结构和表面图案,HMC 3D支架管根据我们之前的结果在胃肠道中保留了很长时间。本文进一步探究了3D支架管是否可以增加装载的R.i在大鼠中的保留时间。荧光标记的R.i被装载到3D支架管中并喂给大鼠,同时使用游离的R.i作为对照。在不同时间点对接受游离R.i或3D Sca@R.i的大鼠的肠道进行了体外成像。结果显示,游离R.i的信号在12小时内迅速减弱,表明通过口服管理游离R.i在肠道中的定植明显减少。然而,装载在支架内的R.i在肠道中的保留时间要长得多(至少72小时)(图3N和O)。对大鼠粪便中的荧光信号分析(图3P和Q)和肠道组织的免疫荧光分析(图3R)进一步支持了本文的结果,表明接受3D Sca@R.i的大鼠排出的R.i比接受游离R.i的大鼠少。此外,通过使用遗传荧光素酶标记,可以使用生物发光追踪益生菌在体内的生物分布。在给予3D Sca@R.i后144小时仍可观察到益生菌的信号,与对照组相比(图3S至T),表明3D支架有效地促进了益生菌在肠道中的定植,而不是水凝胶载体或直接口服益生菌。此外,在口服给予3D Sca@R.i后,实验动物的主要血液生化指标变化不大,证明了这一策略的生物安全性。R.i在肠道中的长时间保留是对肠道微生物群产生显著影响的前提。 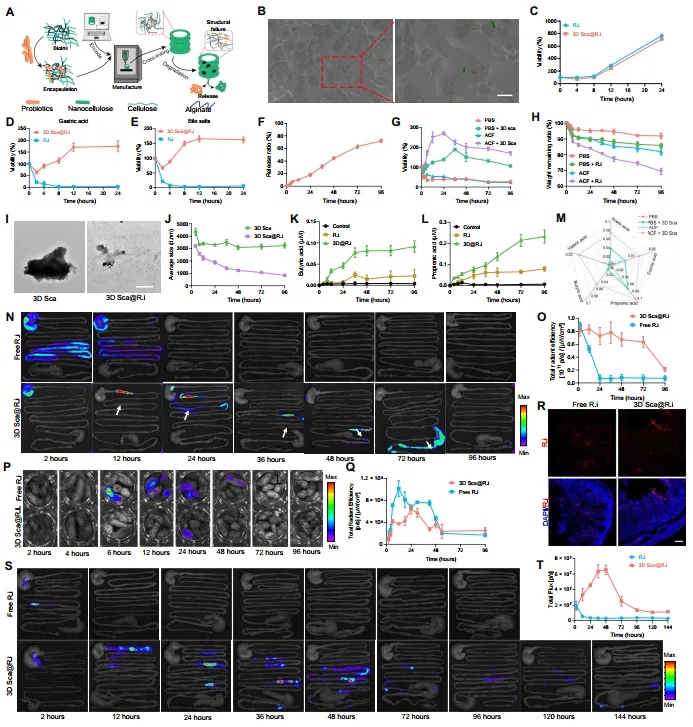
图3 3D纤维素支架促进益生菌的生长和定植
【在高脂饮食喂养的大鼠中调节肠道微生物群】 如图4A所示,喂食高脂饮食(HFD)的大鼠通过口服灌胃接受3D Sca@R.i治疗(108 CFU),每周一次,共四次。使用相同剂量的游离R.i或空白3D支架(3D Sca)作为对照。在第9周,使用16S RNA鉴定经过各种处理后的大鼠微生物群落。HFD可能导致不同微生物物种的相对丰度失衡,例如,与未处理的大鼠相比,喂食HFD的大鼠中的厚壁菌门和拟杆菌门明显较低(图4B和C)。与对照治疗相比,3D Sca@R.i治疗改善了喂食HFD的大鼠的微生物群平衡。本文在喂食HFD的大鼠中观察到,经过3D Sca@R.i治疗后,肠道微生物组成显著改善(图4B和C)。与本研究团队之前的结果一致,单独喂食游离R.i对喂食HFD的小鼠肠道内R.i的相对丰度影响最小,这表明在喂食HFD的小鼠中,R.i的定植受到显著影响。相比之下,与对照组相比,口服灌胃3D Sca@R.i后,R.i细菌的相对丰度显著更高,表明3D Sca@R.i对大鼠肠道中R.i的活性和定植的影响比单独口服R.i更大(图4D)。 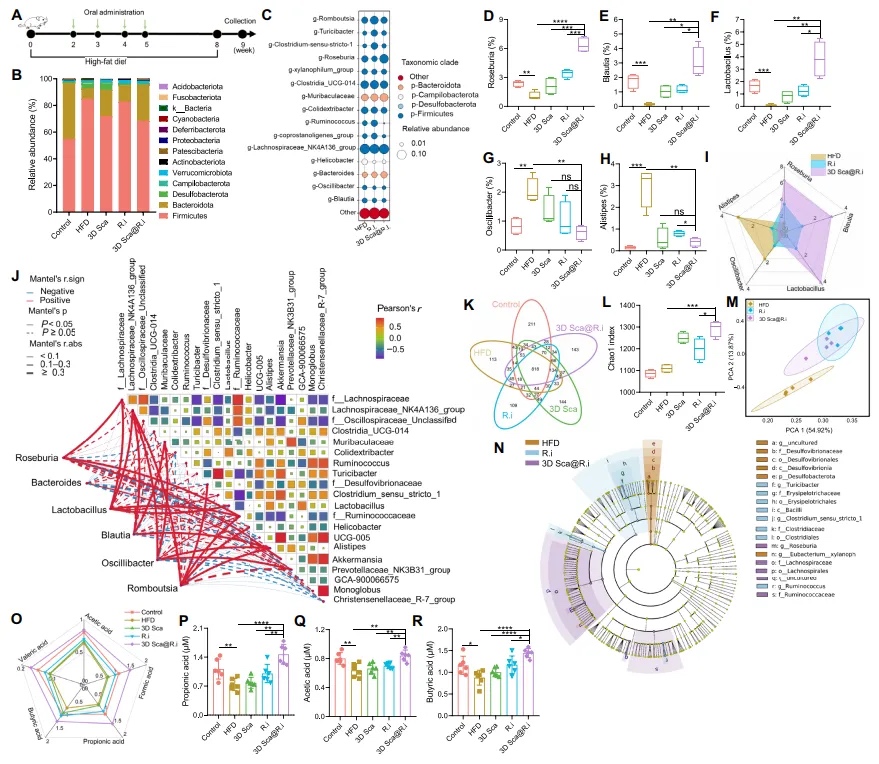
图4 装载R.i的3D支架改善了高脂饮食在肠道中引起的微生物紊乱,并重塑了肠道微环境
【3D Sca@R.i在治疗HFD诱导的肥胖症中的作用】 鉴于3D Sca@R.i在调节与肥胖相关的肠道微生物物种和组成方面的显著作用,本文接下来探究了3D Sca@R.i是否可以逆转大鼠中HFD诱导的肥胖。大鼠被喂食HFD共8周。在第2周,大鼠接受3D Sca@R.i、游离R.i或空白支架治疗,如图4A所示。尽管单独的游离R.i或空白支架对体重增长影响最小,但3D Sca@R.i显著延迟了体重增长,包括绝对体重增长和相对体重变化率(图5A至C)。同时,收集了实验大鼠的白色脂肪组织(WAT)。接受空白支架或游离R.i治疗的大鼠由于纤维素的微弱调节作用而略微减少了脂肪生成,而接受3D Sca@R.i的大鼠显著抑制了WAT的形成(图5D至F)。此外,接受3D Sca@R.i治疗的大鼠的Lee氏指数和体质指数也比对照组有所改善(图5G和H),以及包括甘油三酯(TGs)、总胆固醇(TCHO)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)在内的各种主要脂质生化标志物,在治疗后都趋于正常化(图5I至L)。 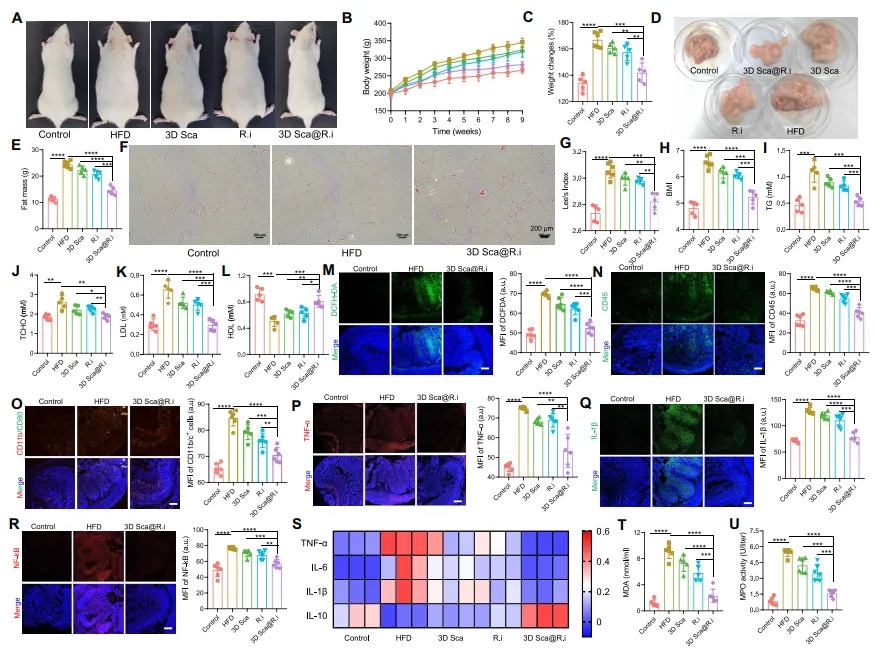
图5 装载益生菌的3D纤维素支架改善了免疫微环境并调节了肥胖程度
【3D Sca@R.i对炎症性肠病(IBD)的治疗效果】 为了进一步扩展本文提出的肠道递送系统的应用范围,本文探究了其在治疗其他与肠道相关疾病中的疗效。炎症性肠病(IBD),如克罗恩病和溃疡性结肠炎,是一种以胃肠道慢性炎症为特征的病症。为探索3D Sca@R.i在治疗IBD中的疗效,本文用硫酸葡聚糖钠(DSS)盐口服处理大鼠7天以诱导急性肠炎(图6A)。IBD大鼠按照先前描述的方法用3D Sca@R.i、游离R.i或空白支架进行治疗。同样,3D Sca@R.i显著重塑了肠道微生物群的丰度和多样性(图6B至E)。在接收3D Sca@R.i的大鼠中,R.i的种群数量显著高于喂食游离R.i的大鼠(图6F)。此外,相关益生菌和相关短链脂肪酸的丰度显著增加。然而,致病细菌的丰度减少了(图6G至J)。主成分分析(PCA)显示,大鼠的肠道菌群倾向于恢复正常水平,进一步证实该治疗促进了肠道菌群失调的修复(图6K),并且导致大鼠中各种短链脂肪酸的水平最高(图6L)。 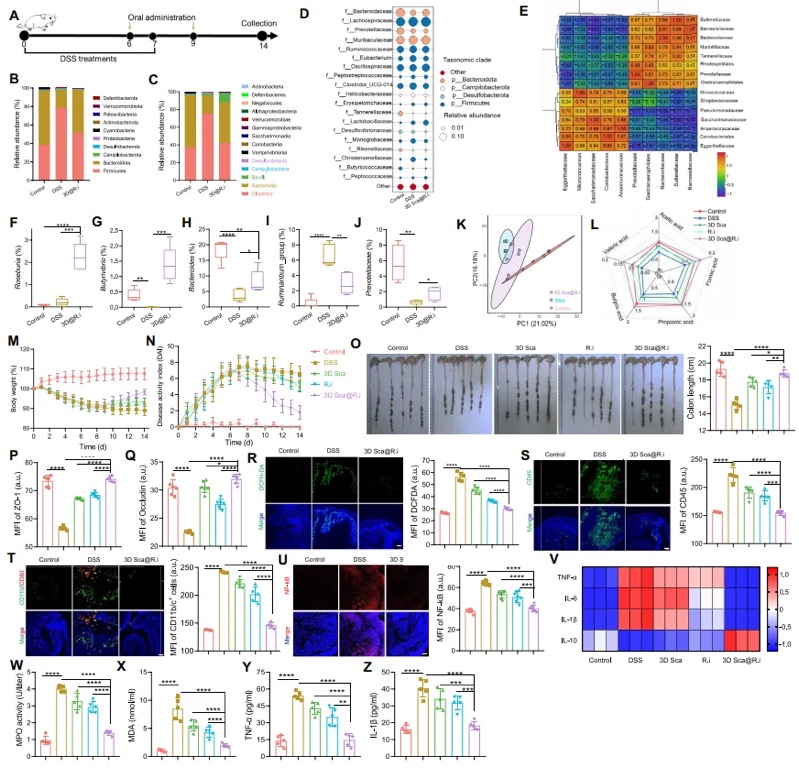
图6 3D纤维素支架平台调节了急性肠炎
2.总结与展望 总之,本文设计了一种由纤维素衍生的3D打印益生菌递送载体,通过独特的表面图案有效地延长了其在肠道中的保留时间。此外,3D打印载体可以促进装载的益生菌的生存和定植,改善肠道微生物群失调并调节肠道炎症。本文展示了3D打印益生菌递送载体在治疗大鼠肥胖症和炎症性肠病方面的治疗效果。这种方法为提高益生菌定植效率和促进肠道相关疾病的治疗提供了潜在的平台。 (责任编辑:admin) |