4.3.1. 三点弯曲测试
三点弯曲试验用来检测支架的弯曲性能(柔顺性),柔顺性好的支架在支架介入治疗过程中能够更容易通过动脉弯曲部分。支架柔顺性大小用弯曲刚度来表示:弯曲刚度越大,支架柔顺性越小。弯曲刚度通过E· I 计算,具体表示为[26,28]:
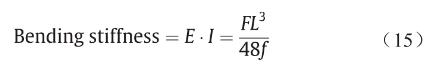
式中,F为外弯曲力;L为支架跨度;f为支架弯曲挠度。本实验中,L为11 mm,因此,当变形f设为固定值,对应更小外力F的支架具有更好的支架柔顺性。当变形f 为2 mm时,A、B、C三组支架对应的外力F如图9(d)所示;B、D、E三组支架对应的外力F如图9(h)所示。
由图9(a)~(d)可知,A、B、C三组柔顺性关系为B1 < A1 ≈ C1、A2 < B2 < C2和A3<B3<C3;随着连接杆长度从1.00 mm增加到1.50 mm,对Ф2、Ф3和Ф4支架,各组间的C组与A组支架(C1/A1, C2/A2, C3/A3)外力F之比分别为1.01、0.77、0.49。由图9(e)~(h)可知,B、D、E三组柔顺性关系为E1 < B1 < D1、E2 < B2 < D2、E3 < B3 < D3。
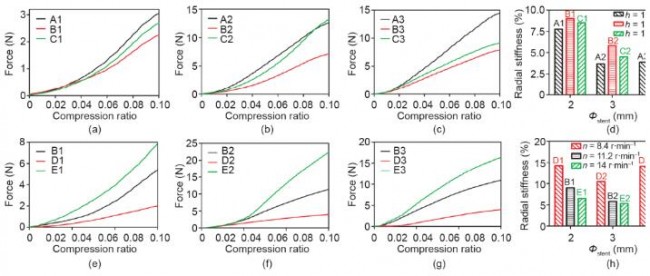 图9.不同结构和制造参数的3D打印PCL支架的三点弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm时(对应A、B、C三组),各组支架外力F与支架变形曲线图;(d)当支架变形为2 mm时,各组支架对应的外力F大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架变形曲线图;(h)当支架变形为2 mm时,各组支架对应的外力F大小。图(d)和(h)中的数据以平均值±误差方式表示。 图9.不同结构和制造参数的3D打印PCL支架的三点弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm时(对应A、B、C三组),各组支架外力F与支架变形曲线图;(d)当支架变形为2 mm时,各组支架对应的外力F大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架变形曲线图;(h)当支架变形为2 mm时,各组支架对应的外力F大小。图(d)和(h)中的数据以平均值±误差方式表示。
© Engineering
表3所示为变形f为2 mm时,各组支架的弯曲刚度值(平均值)。据报道[29],此前商业化的Absorb GT1 支架弯曲刚度值为4.20 N· mm2 ,这与A1、C1、C3、 D1~D3等几组支架弯曲刚度值接近。因此,A1、C1、 C3、D1~D3支架具有相对合适的弯曲柔顺性。
表3 3D打印PCL支架实验各组弯曲刚度值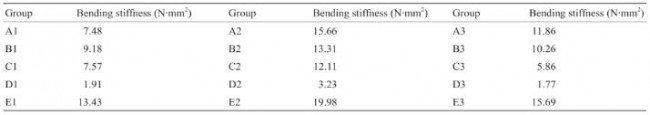
4.3.2. 径向压缩测试
径向压缩试验用于评估径向强度,从而确定支架的径向支撑力。具有良好径向强度的支架可以提供更好的支撑。径向强度可以用径向刚度表示:径向刚度越大,径向强度越小。Schmidt等[30]提出将支架径向刚度定义为支架直径从外压0到外压0.2 bar (1 bar = 105 Pa)时的变化程度[式(16)]。ASTM标准F3067-14 [27]建议使用瞬时支架直径来计算支架压缩比,而非仅适用初始直径[式(17)、(18)]。因此,径向刚度是当作用在支架上的瞬时压力为0.2 bar时的压缩比。

支架径向强度主要与支撑杆宽度t以及Z形环数目有关。由图10(a)~(d)可知,A、B、C三组支架径向刚度关系为Bi>Ci>Ai(i = 1, 2, 3),因此三组支架径向强度关系为Bi<Ci<Ai(i = 1, 2, 3);由图10(e)~(h)可知,B、D、E三组支架径向刚度关系为Di>Bi>Ei(i = 1, 2, 3),因此三组支架径向强度关系为Di<Bi<Ei (i = 1, 2, 3)。
据报道[30],商业化支架径向刚度从0.51%到 3.99%,这与A2、A3、C2、C3、E3支架相近。因此, A2、A3、C2、C3、E3支架具有相对合适的径向强度。
 图10.不同结构和制造参数的3D打印PCL支架的径向弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm(对应A、B、C三组)时,各组支架外力F与支架压缩比曲线图;(d)(a)~(c)中各组支架径向刚度大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架压缩比曲线图;(h)(e)~(g)中各组支架径向刚度大小。(d)和(h)中的数据以平均值±误差表示。 图10.不同结构和制造参数的3D打印PCL支架的径向弯曲测试结果。(a)~(c)支架连接杆长度分别为1 mm、1.25 mm和1.5 mm(对应A、B、C三组)时,各组支架外力F与支架压缩比曲线图;(d)(a)~(c)中各组支架径向刚度大小;(e)~(g)螺杆喷头转速为8.4 r·min−1 、11.2 r·min−1 和14 r·min−1 (对应D、B、E三组)时,各组支架外力F与支架压缩比曲线图;(h)(e)~(g)中各组支架径向刚度大小。(d)和(h)中的数据以平均值±误差表示。
© Engineering
4.3.3. 径向扩张测试
径向扩张测试中,C1、C2组支架均分别膨胀至扩张比为10%、20%。即C1组支架由直径2 mm分别扩张至2.2 mm、2.4 mm,C2组支架由直径3 mm分别扩张至 3.3 mm、3.6 mm,分别测量支架长度;随后,去除扩张力,观察支架径向回弹,并记录支架此时的长度。支架初始直径OФ、扩张最大直径MФ以及回弹后直径RФ如图 11(a)所示。支架直径回缩比计算如下:
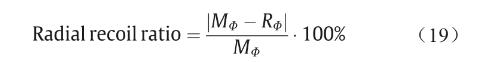
C1支架在扩张至110%和120%时,支架直径回弹分别为69%和41%;C2支架在扩张至110%和120%时,支架直径回弹分别为77%和71%。3D打印PCL支架的径向回缩程度较大,这与PCL支架良好的弹性有关。为解决此问题,未来的研究将探索其他生物材料。
支架初始长度OL、扩张最大长度ML以及回弹后长度RL如图11(b)所示。支架轴向回缩比计算如下:

C1支架在扩张至110%和120%时,支架径向回弹分别为0.33%和0.13%;C2支架在扩张至110%和120%时,支架直径回弹分别为0.40%和0.09%。作为对比,目前商业化支架轴向回缩在3%~5% [31]。因此,可以确定本研究中所使用的支架设计具有相对稳定可靠的轴向长度稳定性。
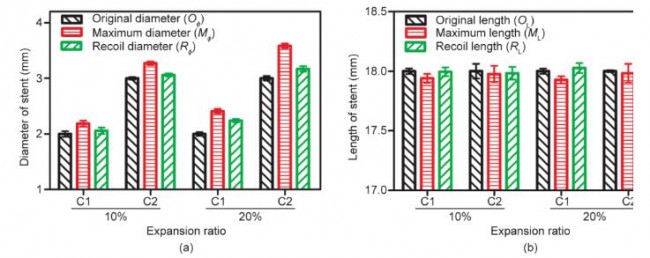 图11. 径向扩张结果。(a)支架直径变化;(b)支架长度变化。所有数据以平均值±误差表示。 图11. 径向扩张结果。(a)支架直径变化;(b)支架长度变化。所有数据以平均值±误差表示。
© Engineering
4.4. 支架生物相容性
3D打印PCL支架溶血分析实验按照ASTM标准 F756-17开展[32],新鲜人血由北京华信医院/清华大学第一附属医院合法提供。如前报道[33],样品溶血率通过测量血红蛋白释放量来确定,可表示为:
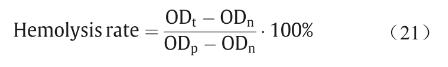
式中,ODt代表实验组吸光度;ODp和ODn分别表示阳性组和阴性组吸光度值。根据ASTM标准F756-17[32],材料溶血率可分级为非溶血(0~2%)、轻微溶血(2%~5%)、溶血(>5%)。3D打印PCL支架溶血率为 0.07% ± 0.02%(非溶血)。
3D打印PCL支架细胞相容性实验按照ISO标准 10993–5:2009开展[34],使用EGM-2 (endothelial cell growth medium-2)培养基(瑞士Lonza公司,货号 cc3162)培养人脐静脉内皮细胞(HUVECs,美国 ATCC细胞库),将支架在37 ℃培养基中孵育24 h提取材料浸提液。将HUVECs在37℃、5% CO2、浸泡支架 24 h后的EGM-2培养基中培养96 h后,加入CCK-8(cell counting kit-8,日本Dojindo公司)孵育4 h后,使用酶标仪测量细胞活性,计算公式为:
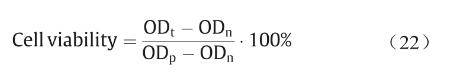
式中,ODt代表实验组吸光度;ODp和ODn分别表示阳性组和阴性组吸光度值。根据细胞活性值,材料的细胞毒性可分为0级(≥ 100%)、1级(80%~99%)、2级(50%~79%)、3级(30%~49%)和4级(0~29%)。当材料细胞毒性大于2级时,认为其具有细胞毒性。3D打印 PCL支架细胞活性为90% ± 5%(1级),因此,可以用于细胞实验。
综上,3D打印PCL支架具有良好的生物相容性。
 5. 讨论 5. 讨论
5.1. 成型参数对打印能力与结构成型的影响
5.1.1. 喷头加热温度
支架制备前,通过PCL单丝挤出试验研究了螺杆挤出喷头加热温度对PCL丝尺寸稳定性和强度的影响,研究得知在80 ℃和82.5 ℃时PCL丝具有更好的尺寸稳定性[图4(c)],在75 ℃和80 ℃显示更好的拉伸强度。因此,综合考虑到材料成型强度和尺寸稳定性,将螺杆挤出喷头加热温度设定为80 ℃用于支架制备。如图4 (b)、(d)所示,在80 ℃下挤出的PCL丝具有良好的表面形貌。
5.1.2. x-y-z 运动速度、旋转轴转动速度
如表1所示,可通过调节平台移动速度VRx和螺杆喷头转速n改变支架丝宽(支撑杆宽度)。随VRx增加,支架丝宽减小且打印稳定性下降(误差系数增大);随螺杆喷头转速n增加,支架丝宽增大而打印稳定性提升(误差系数减小)。因此,综合考虑打印稳定性(如误差系数小于10%)与打印效率,将VRx设为1 mm· s−1 ,丝宽通过改变螺杆转速n调节。相应地,x轴移动速度Vx为 图片 mm· s−1 (0.866 mm· s−1 ),旋转轴转动线速度VR为 0.5 mm· s−1 (旋转轴转速可通过nm = VR×60/πФ计算,nm = 30/πФ,单位:r·min−1 ,Ф为支架直径)。
5.1.3. 螺杆挤出速度
在制备不同参数组支架时,螺杆喷头转速n分别设为8.4 r· min−1 (D组)、11.2 r· min−1 (A、B、C 组)、14 r· min−1 (E组)。如图7所示,支架丝宽t与螺杆转速n呈正相关:随螺杆转速增加,支架丝宽增大(D<A=B=C<E)。A、B、C三组支架采用相同转速制备,但是,与A、B组支架相比,C组支架具有相对较大的支架丝宽。因此,在未来的研究中需要进一步提高支架制造的稳定性。
5.2. 结构参数对 3D 打印 PCL 支架机械性能影响
之前已有研究使用了各种方法检测支架的机械性能,弯曲柔顺性和径向强度是支架机械性能的两个重要指标,与支架的几何参数密切相关[14,28]。基于4.3.1节和4.3.2节的讨论可知,弯曲柔顺性可用弯曲刚度表示,较高的弯曲刚度表明支架较低的柔韧性;径向强度可用径向刚度表示,较高的径向刚度表明较低的径向强度。在本研究中,影响支架机械性能的主要参数是连接杆的长度h和支架丝宽t。
5.2.1. 连接杆长度
A、B、C三组支架对应连接杆长度h分别为1 mm、 1.25 mm和1.5 mm,而支架长度固定(18 mm),因此随着连接杆长度h增加,支架具有更少的Z形环,支架弯曲性能随之增加而径向强度下降。因此,理想的支架弯曲性能和径向强度结果应为:Ai<Bi<Ci、Ci<Bi<Ai (i =1, 2, 3)。
由图9(a)~(d)和表3可知,A、B、C三组弯曲性能对比为:B1<A1≈C1、A2<B2<C2、A3<B3<C3。总体而言,随着连接杆长度h增加,支架弯曲性能提高,在支架直径较大时表现更加明显。由图10(a)~(d)可知,A、B、C三组支架径向强度:Bi<Ci<Ai (i =1, 2, 3),这与理想结果有所偏差,在5.2.2节中会进一步解释此现象。
总之,具有更长连接杆的支架在柔顺性上具有优势。但是,在这一部分并不确定长连接杆(在支架丝宽略微存在区别的情况下)是否严格不利于径向强度。
5.2.2. 支架丝宽
D、B、E三组支架对应螺杆喷头转速t分别为 8.4 r·min−1 、11.2 r·min−1 、14 r·min−1 ,支架丝宽与螺杆转速正相关,随着转速增加,支架丝宽增大,随之导致更大的径向强度和更低的弯曲柔顺性。因此,D、B、E三组支架对比的理想结果为:柔顺性Ei<Bi<Di,径向强度 Di<Bi<Ei(i = 1, 2, 3)。
由图7、图9、图10可知,实际测试结果与上述理想结果一致,因此,可得支架丝宽是支架径向强度的主要因素。此外,5.2.1节中提到,A、B、C三组支架径向强度Bi<Ci<Ai (i =1, 2, 3),这与理想结果Ci<Bi<Ai 不一致。该结果可以通过支架丝宽解释:从图7(f)可以确定,尽管C组支架具有更少的Z形环,但由于其丝宽更大,与B组相比,其径向强度更大。这进一步证明了支架丝宽是决定支架径向强度的主导因素。
5.2.3. 小结
根据5.2.1节和第5.2.2节的讨论,可以看出支架柔顺性和径向强度是一对相互矛盾的性能。这是为实现支架综合机械性能而需权衡支架结构参数的结果。对于相同直径的支架,支架的机械性能(弯曲柔顺性和径向强度)与连接杆长度和支架丝宽密切相关。
支架弯曲柔顺性。综上可知,具有较长连接杆和较小丝宽的相同直径支架倾向于具有更好的弯曲柔顺性。因此,具有松散几何结构的支架倾向于表现出更好的柔顺性。
径向强度。结合上述讨论,可以推断出支架丝宽(t)是影响支架径向强度的主要因素,这可以结合式(12)得到验证。式(12)表明支架的结构强度与t3 成正比,与h成反比。这意味着支架的径向强度更易受到t的影响。可以推断,具有较大连接杆(h)和适中支架丝宽的支架更有利于在柔顺性与径向强度之间取得平衡。
 6. 结论 6. 结论
本研究中,研究人员开发了一种新型基于微螺杆挤出式 3D打印系统,通过增加第四轴旋转轴制造支架。研究提出了一种新型ZPR结构心血管支架,并证明了支架扩张后可保持轴向长度稳定。通过单丝实验初步研究了适合支架制备的成型参数,随后采用“重合打印法”制备具有不同材料(PLLA、PCL)、形状、几何结构的支架,进一步研究了不同参数成型PCL支架的机械性能。
综上,本文提出的基于微螺杆挤出的3D打印系统显示出个性化制备支架的潜力。然而,PCL支架柔顺性的不足表明在未来的研究中需进一步改进支架设计。此外,与金属支架相比,PCL支架在径向强度和径向回弹方面并不理想,之后还需探索制备PLLA或具有更高强度和更低伸长率的可降解聚合物支架。
参考文献
[1] Stettler C, Wandel S, Allemann S, Kastrati A, Morice MC, Schömig A, et al. Outcomes associated with drug-eluting and bare-metal stents: a collaborative network meta-analysis. Lancet 2007;370:937–48.
[2] Zhang Y, Bourantas CV, Farooq V, Muramatsu T, Diletti R, Onuma Y, et al. Bioresorbable scaffolds in the treatment of coronary artery disease. Med Devices Evid Res 2013;6:37–48.
[3] Wiebe J, Nef HM, Hamm CW. Current status of bioresorbable scaffolds in the treatment of coronary artery disease. J Am Coll Cardiol 2014;64:2541–51.
[4] Ang HY, Bulluck H, Wong P, Venkatraman SS, Huang Y, Foin N. Bioresorbable stents: current and upcoming bioresorbable technologies. Int J Cardiol 2017;228:931–9.
[5] Joner M, Finn AV, Farb A, Mont EK, Kolodgie FD, Ladich E, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk. J Am Coll Cardiol 2006;48:193–202.
[6] Onuma Y, Ormiston J, Serruys PW. Bioresorbable scaffold technologies. Circ J 2011;75:509–20.
[7] Iqbal J, Onuma Y, Ormiston J, Abizaid A, Waksman R, Serruys P. Bioresorbable scaffolds: rationale, current status, challenges, and future. Eur Heart J 2014;35:765–76.
[8] Stepak B, Anton´ czak AJ, Bartkowiak-Jowsa M, Filipiak J, Pezowicz C, Abramski KM. Fabrication of a polymer-based biodegradable stent using a CO2 laser. Arch Civ Mech Eng 2014;14:317–26.
[9] Guerra AJ, Farjas J, Ciurana J. Fibre laser cutting of polycaprolactone sheet for stents manufacturing: a feasibility study. Opt Laser Technol 2017;95:113–23.
[10] Guerra AJ, Ciurana J. 3D-printed bioabsordable polycaprolactone stent: the effect of process parameters on its physical features. Mater Des 2018;137:430–7.
[11] Martinez AW, Chaikof EL. Microfabrication and nanotechnology in stent design. WIREs Nanomed Nanobiotechnol 2011;3:256–68.
[12] Kaesemeyer WH, Sprankle KG, Kremsky JN, Lau W, Helmus MN, Ghatnekar GS. Bioresorbable polystatin fourth-generation stents. Coron Artery Dis 2013;24:516–21.
[13] Park SA, Lee SJ, Lim KS, Bae IH, Lee JH, Kim WD, et al. In vivo evaluation and characterization of a bio-absorbable drug-coated stent fabricated using a 3Dprinting system. Mater Lett 2015;141:355–8.
[14] Wu Z, Zhao J, Wu W, Wang P, Wang B, Li G, et al. Radial compressive property and the proof-of-concept study for realizing self-expansion of 3D printing polylactic acid vascular stents with negative poisson’s ratio structure. Materials 2018;11(8):1357.
[15] Wang WQ, Liang DK, Yang DZ, Qi M. Analysis of the transient expansion behavior and design optimization of coronary stents by finite element method. J Biomech 2006;39:21–32.
[16] Stoeckel D, Bonsignore C, Duda S. A survey of stent designs. Minim Invasive Ther Allied Technol 2002;11:137–47.
[17] Attard D, Grima JN. Modelling of hexagonal honeycombs exhibiting zero Poisson’s ratio. Phys Status Solidi Basic Res 2011;248:52–9.
[18] Masters IG, Evans KE. Models for the elastic deformation of honeycombs. Compos Struct 1996;35:403–22.
[19] Young WC, Budynas RG. Roark’s formulas for stress and strain. 7th ed. Beijing: Tsinghua University Press; 2003. Chinese.
[20] Grima JN, Oliveri L, Attard D, Ellul B, Gatt R, Cicala G, et al. Hexagonal honeycombs with zero Poisson’s ratios and enhanced stiffness. Adv Eng Mater 2010;12:855–62.
[21] Venkataraman N, Rangarajan S, Matthewson MJ, Harper B, Safari A, Danforth SC, et al. Feedstock material property—process relationships in fused deposition of ceramics (FDC). Rapid Prototyp J 2000;6:244–52.
[22] Liu B, Xie Y, Wu M. Research on the micro-extrusion characteristic of mini-screw in the screw extruding spray head. Polym Bull 2010;64: 727–38.
[23] Wang F, Shor L, Darling A, Khalil S, Sun W, Güçeri S, et al. Precision extruding deposition and characterization of cellular poly-e-caprolactone tissue scaffolds. Rapid Prototyp J 2004;10:42–9.
[24] Capone C, Di Landro L, Inzoli F, Penco M, Sartore L. Thermal and mechanical degradation during polymer extrusion processing. Polym Eng Sci 2007;47:1813–9.
[25] Liu C, Li Y, Zhang L, Mi S, Xu Y, Sun W. Development of a novel lowtemperature deposition machine using screw extrusion to fabricate poly(Llactide-co-glycolide) acid scaffolds. Proc Inst Mech Eng Part H J Eng Med 2014;228:593–606.
[26] F2606-08 Standard guide for three-point bending of balloon expandable vascular stents and stent systems. US Standard. West Conshohocken: American Society of Testing Materials; 2014.
[27] F3067-14 Guide for radial loading of balloon expandable and self expanding vascular stents. US Standard. West Conshohocken: American Society of Testing Materials; 2014.
[28] Wang Q, Fang G, Zhao Y, Wang G, Cai T. Computational and experimental investigation into mechanical performances of poly-L-lactide acid (PLLA) coronary stents. J Mech Behav Biomed Mater 2017;65:415–27.
[29] Schmidt W, Behrens P, Brandt-Wunderlich C, Siewert S, Grabow N, Schmitz KP. In vitro performance investigation of bioresorbable scaffolds—standard tests for vascular stents and beyond. Cardiovasc Revascularization Med 2016;17:375–83.
[30] Schmidt W, Lanzer P, Behrens P, Topoleski LDT, Schmitz KP. A comparison of the mechanical performance characteristics of seven drug-eluting stent systems. Catheter Cardiovasc Interv 2009;73:350–60.
[31] Colombo A, Stankovic G, Moses JW. Selection of coronary stents. J Am Coll Cardiol 2002;40:1021–33.
[32] F756-17 Standard practice for assessment of hemolytic properties of materials. US Standard. West Conshohocken: American Society of Testing Materials; 2017.
[33] Im SH, Kim CY, Jung Y, Jang Y, Kim SH. Biodegradable vascular stents with high tensile and compressive strength: a novel strategy for applying monofilaments via solid-state drawing and shaped-annealing processes. Biomater Sci 2017;5:422–31.
[34] ISO 10993-5:2009 Biological evaluation of medical devices—part 5: tests for in vitro cytotoxicity. EN Standard. Geneva: International Organization for Standardization; 2009.
(责任编辑:admin) |