3D打印Janus异质微球精准控释实现全周期调控骨再生(2)
时间:2024-08-27 08:43 来源: EngineeringForLife 作者:admin 点击:次
3.Janus异质微球实现精准免疫调控 各组Janus异质微球与巨噬细胞RAW264.7共培养后,早期高浓度钙离子的释放(Fast组)将驱使巨噬细胞向M1表型极化,而低浓度缓慢释放CPO(Delayed组和Sequence组)则能促进M2型巨噬细胞分化(图3 A-F),抑制促炎因子TNF-a,并促进抗炎因子IL-10的分泌(图3 G)。RNA-seq结果进一步提示,该免疫调控过程可能通过激活JAK-STAT信号通路,优化了骨免疫微环境,加速了血管化及矿化过程(图3 H-L)。 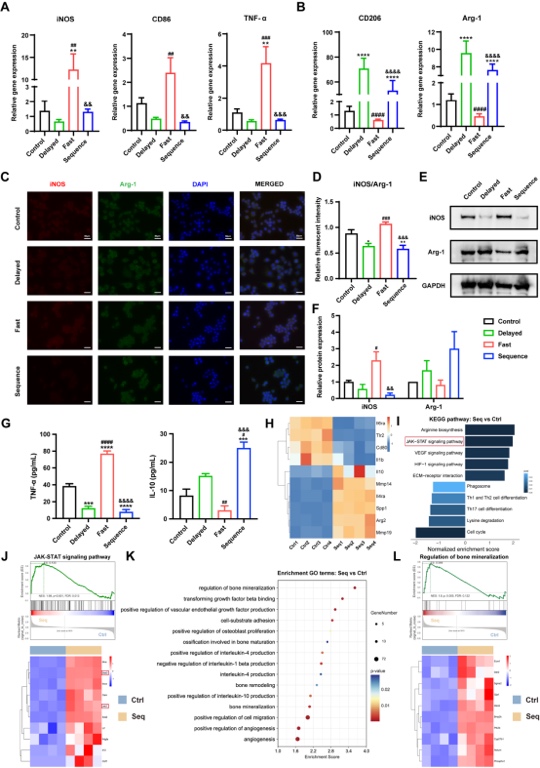
图3 Janus异质微球的免疫调控能力
4.Janus异质微球靶向调控骨再生序列事件 各组Janus异质微球与骨髓间充质干细胞BMSC共培养后,各组细胞增殖及活性良好(图4 A、B),负载双因子的Janus异质微球的成骨活性显著高于无因子负载的纯GelMA组(Control组),特别地,Fast组和Sequence组表现出最为优异的成骨潜能(图4 C-I),这可能与初期相对高浓度释放BMP-2有关,同时,持续缓慢的CPO释放也为晚期矿化过程提供了充足的钙磷原料。RNA-seq结果进一步提示,Sequence组能上调愈合过程中早期、中期及晚期成骨相关基因(图4 J),激活骨再生序列事件中的多个生物学行为及信号通路(图4 K、L),实现对骨修复过程的全周期调控。 
图4 Janus异质微球的成骨性能
5.Janus异质微球通过优化体内骨免疫微环境实现高效骨再生 为进一步评估Janus异质微球的体内免疫调控及促骨再生行为,研究人员首先将各组微球植入至大鼠皮下,术后3、7天后,进行巨噬细胞免疫荧光染色,结果显示,所有组别中均存在不同程度的巨噬细胞(F4/80+)包裹,与体外结果一致的是,早期低浓度释放CPO的Delayed组和Sequence组,具有较高比例的F4/80+CD206+细胞,而Fast组中微球周围则出现大量的F4/80+CD86+细胞,这意味着Janus异质微球的不同控释行为能精准调控体内免疫微环境,持续低浓度钙离子的释放有助于创造利于成骨的抗炎微环境(图5)。将各组微球植入至大鼠颅骨缺损后,Sequence组实现了最高效的骨愈合,术后8周后在微球间观察到大量的新生骨,较其他组别更为成熟,且有完整的骨桥连接,这一现象得益于BMP-2在微球控释系统的高效按需释放,及CPO的持续性释放,既有利于早期免疫调控,也为晚期的骨基质矿化成熟提供了有利条件。 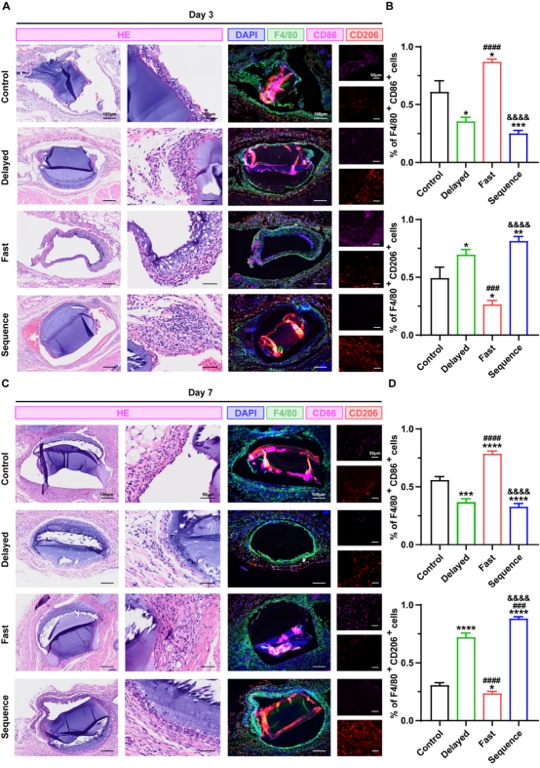
图5 Janus异质微球的体内免疫调控能力
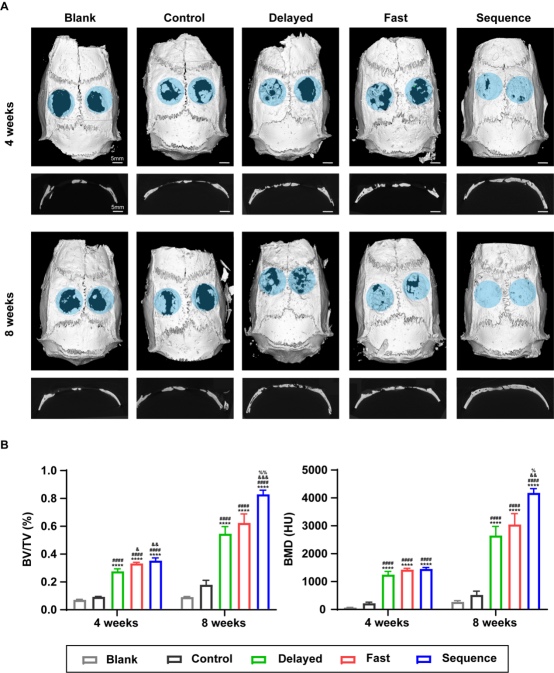
图6 Janus异质微球的体内成骨能力的影像学评估
图7 Janus异质微球的体内成骨能力的组织学评估
综上,该项工作基于Bottom up骨修复理念,通过采用性能高度可调的GelMA水凝胶,实现对双重活性成分的灵活控释,靶向骨再生序列阶段,完成高效骨修复。该策略充分挖掘了GelMA水凝胶固有的理化性能,实现对复杂生物学过程的精准调控,过程中无更多化学成分的添加,为通用性绿色载药控释平台的构建提供了新思路,也为临床转化提供了优良的前提条件。 文章来源: https://doi.org/10.1002/smll.202403835 (责任编辑:admin) |