3D打印时空调控的仿生皮肤
时间:2024-06-19 08:53 来源: EFL生物3D打印与生物制造 作者:admin 点击:次
| 在生物医学工程领域,科学家们一直在探索如何更有效地修复人体组织。通过3D打印技术实现人体组织的模拟和再生,被视为一种极具潜力的解决方案。3D打印技术以其高精度、可定制化和材料多样性等特点,为生物医学工程领域带来了革命性的变化。 最近,来自浙江大学谢志坚、贺永团队设计开发了一种仿生皮肤,包括利用近场直写技术(MEW)制备的PCL膜片,GelMA和HAMA调配的GH凝胶和负载富血小板血浆(PRP)的HAMA凝胶。通过结构仿生和生理仿生,利用时空调控促进了大面积伤口的早期愈合。通过构建了大鼠皮肤缺损伤口模型评估了该仿生皮肤的体内治疗效果。 相关研究成果以“A Spatiotemporal Controllable Biomimetic Skin for Accelerating Wound Repair”为题于2024年2月22日发表在《Small》上。 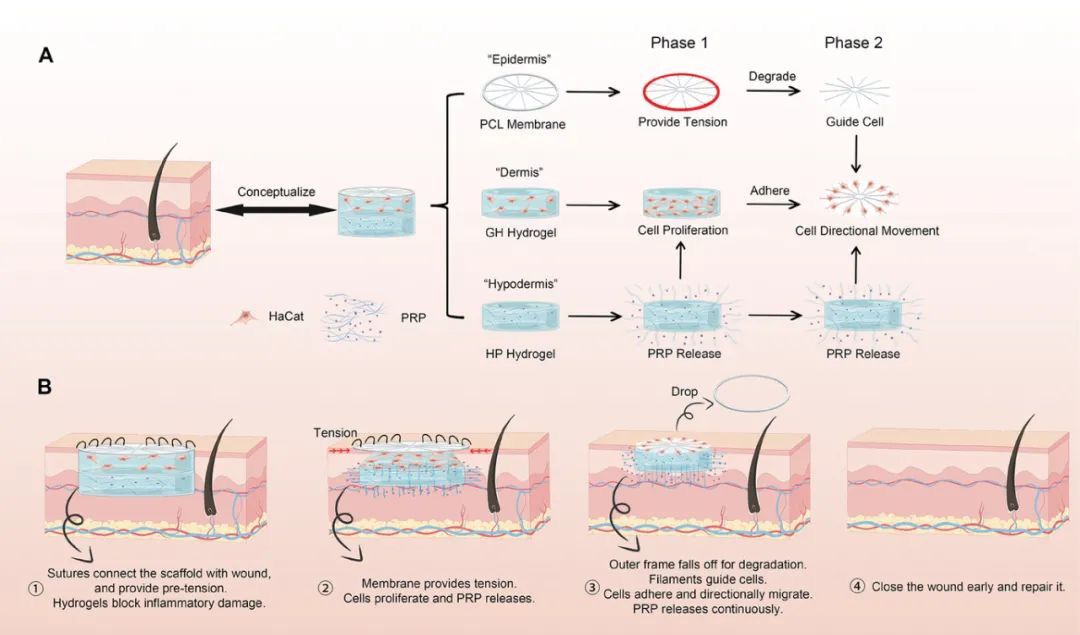
图1 仿生皮肤的的组成和功能示意图
1.向心性PCL膜作为表皮提供力量并促进细胞分化 考虑到从外围到中心的自然伤口愈合过程,设计了一种具有向心力学指数的膜来引导细胞迁移。MEW技术用于打印这种模拟皮肤角质层的多尺度拓扑膜。该膜由用于细胞附着的无序致密纤维(≈10μm)、提供向心力学指数的向心辐条纤维 (50μm) 和用于封装和缝合力的圆周框架纤维 (500μm) 组成。 PCL膜片制备过程及最终产物如图2A.B所示。通过拉伸应力应变实验证具有圆周框架的PCL膜片表现出良好机械性能(图2.C)。利用人永生化角质细胞进行生物学实验,证实了内部存在向心性辐条的PCL膜片能够促进细胞黏附、引导细胞迁移和促进细胞分化(图2.D-H)。 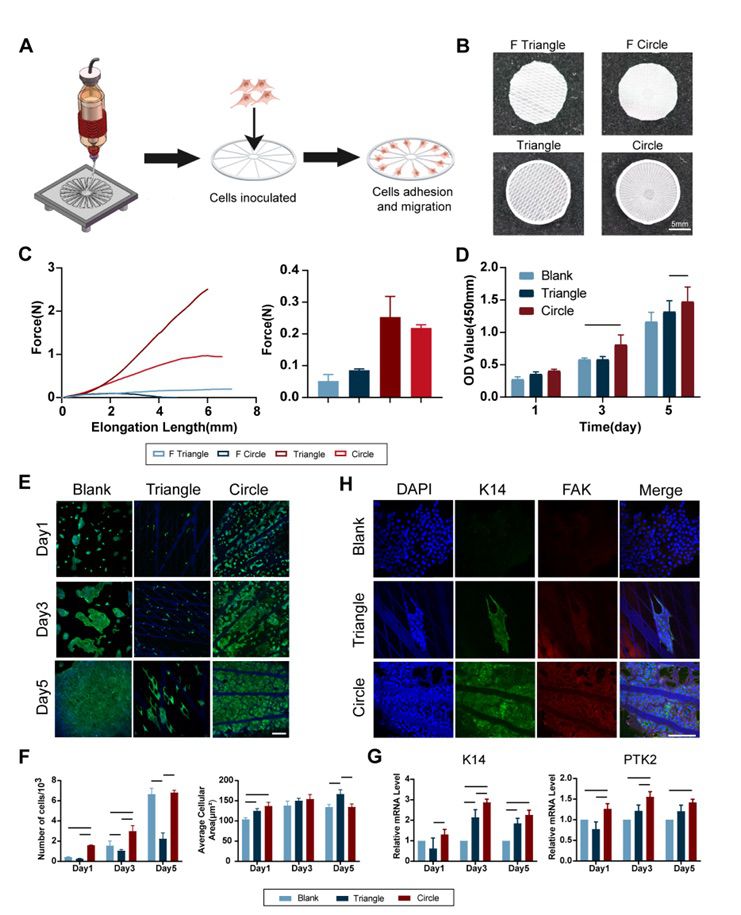
图2 PCL膜片的物理表征和生物学功能探索
2.GH水凝胶作为真皮层携带和释放细胞 在通常持续 3-5 天的炎症反应期间,生物材料需要保护它们携带的细胞。当外周环境变温和时,即在炎症期结束时,生物材料应及时降解以释放细胞,防止阻碍其生长和功能。GelMA作为GH水凝胶的主要成分,其质地柔软且易降解。少量HAMA与GelMA混合可减缓GH水凝胶的降解,增强其机械强度(图3.A)。 调配多种浓度的GH凝胶进行物理表征(图3.B-D)。随着HAMA浓度的增加,GH凝胶的机械强度增加,溶胀曲线无明显差异,但是降解时间呈明显不同。5% GelMA+0.25% HAMA凝胶在第四天时开始快速降解,并于第七天时降解完毕,与伤口修复时炎症期的时间点基本符合,因此作为GH凝胶终选浓度。并且通过实验证实其良好的生物相容性(图3.E, F)。 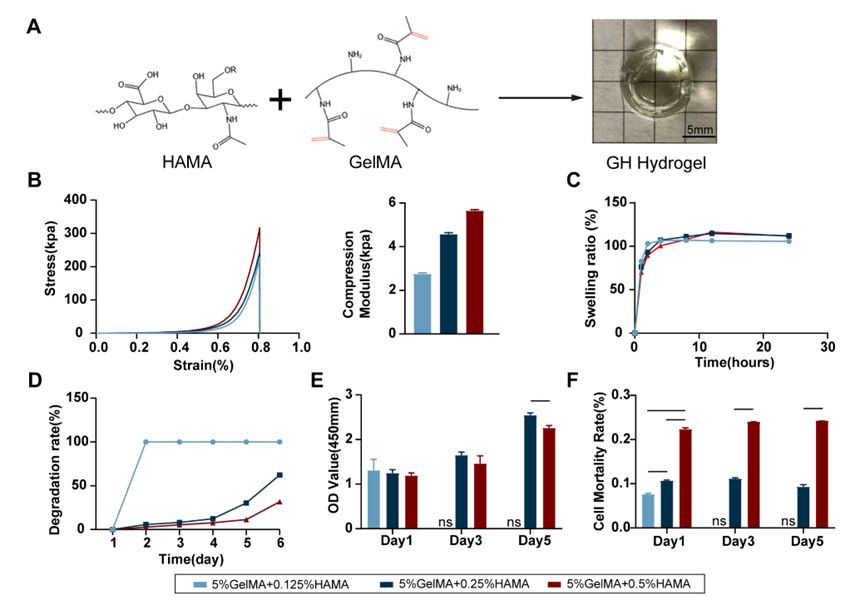
图3 GH凝胶的物理表征和生物学功能探索
3.HP水凝胶作为皮下组织层滋养细胞并促进其迁移 在材料植入后的初始阶段,虽然水凝胶可以减少炎症物质对细胞的影响,但它也阻碍了营养吸收,减缓了细胞增殖。因此,使用HP凝胶持续滋养细胞(图4A)。HAMA是透明质酸的一种改良形式,在伤口中缓慢降解。当与PRP结合时,释放出有益的生物活性因子。HP凝胶不仅在早期作为细胞增殖的营养来源,而且在后期作为细胞迁移的兴奋剂。 调配多种浓度的HP凝胶进行物理表征(图4.B-D)。随着HAMA浓度的增加,HP凝胶的机械强度增加,溶胀减小,降解变慢。表皮生长因子(EGF)作为释放指标进行缓释实验,证实5%HAMA + 20%PRP 释放因子速率稳定且合适,故以此浓度作为后续HP凝胶的浓度。通过用凝胶共培养细胞来评估HP凝胶对细胞增殖和迁移的影响,并最终证实HP凝胶促进角质形成细胞的增殖和迁移(图4.E-J)。 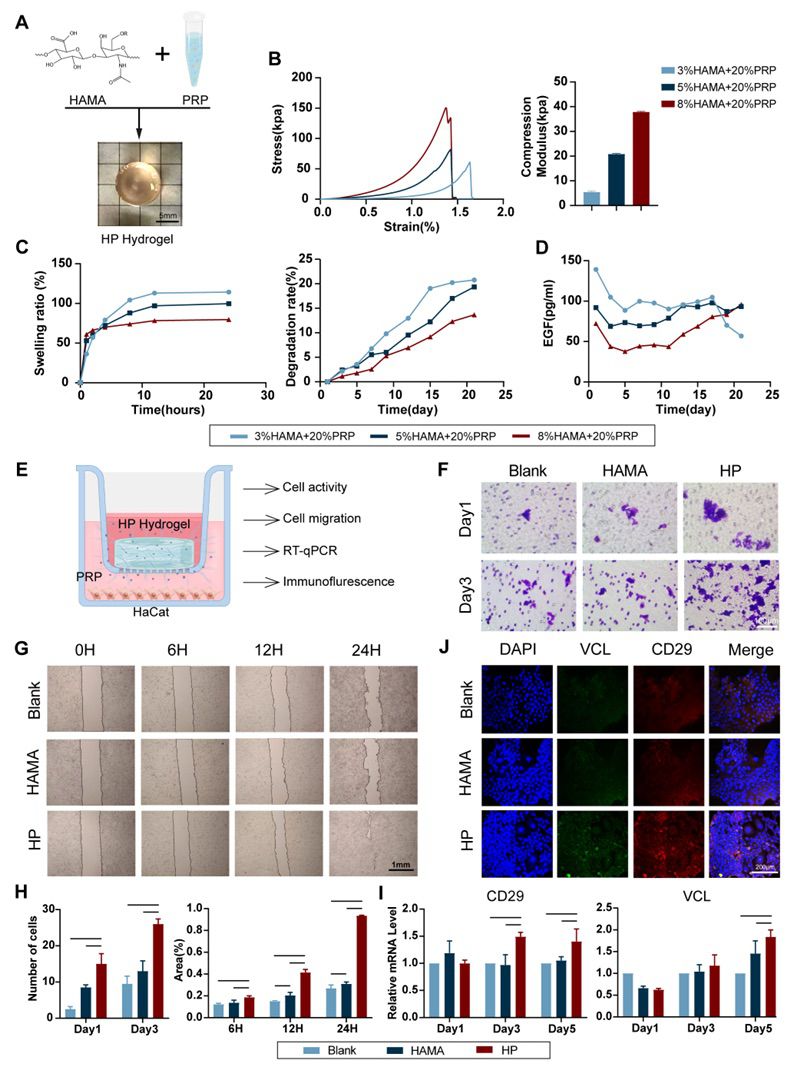
图4 HP凝胶的物理表征和生物学功能探索
4.仿生皮肤具有内部协同效应 仿生皮肤采用逐层铸造构建,其中GH凝胶层嵌入PCL膜片,通过物理嵌合的方式稳定结合。接下来,GH和HP凝胶在405 nm光的激发下,在两者的表面产生C═C双键使之紧密结合。该仿生皮肤使细胞能够同时接受PCL膜和PRP的刺激:PCL膜促进细胞粘附和分化,而HP水凝胶促进细胞增殖和迁移(图5.A)。 建立了四组进行比较:仅具有 GH 水凝胶的空白组 (Blank)、包含 GH 水凝胶和 HP 水凝胶的对照组 (GHP)、由 PCL 膜和 GH 水凝胶组成的另一个对照组 (PCL) 以及具有完整皮肤结构的实验组 (MS)。仿生皮肤同样具有良好的机械强度(图5.B)。生物学实验中仿生皮肤保留了向心性PCL膜片和HP凝胶的功能,且二者同时存在时,相关基因、蛋白呈现显著性高表达(图5.C-G)。结果证实了,PCL膜和HP凝胶在仿生皮肤内具有协同作用,二者相互放大了彼此的生物学效应,同时保留了各自的功能。这种协同作用确保了仿生皮肤作为一个整体发挥更全面的作用。 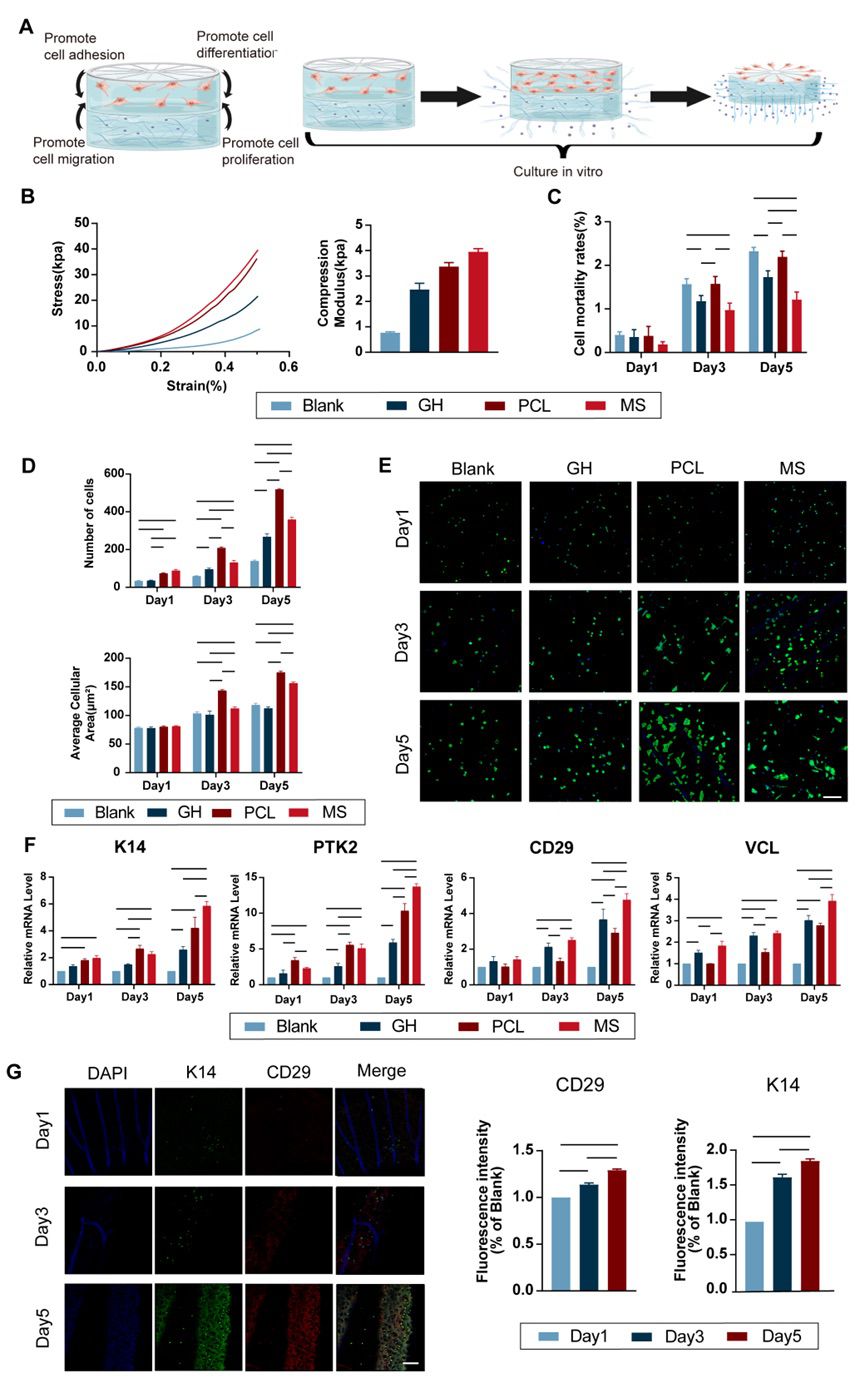
图5 仿生皮肤的物理表征和生物学功能探索
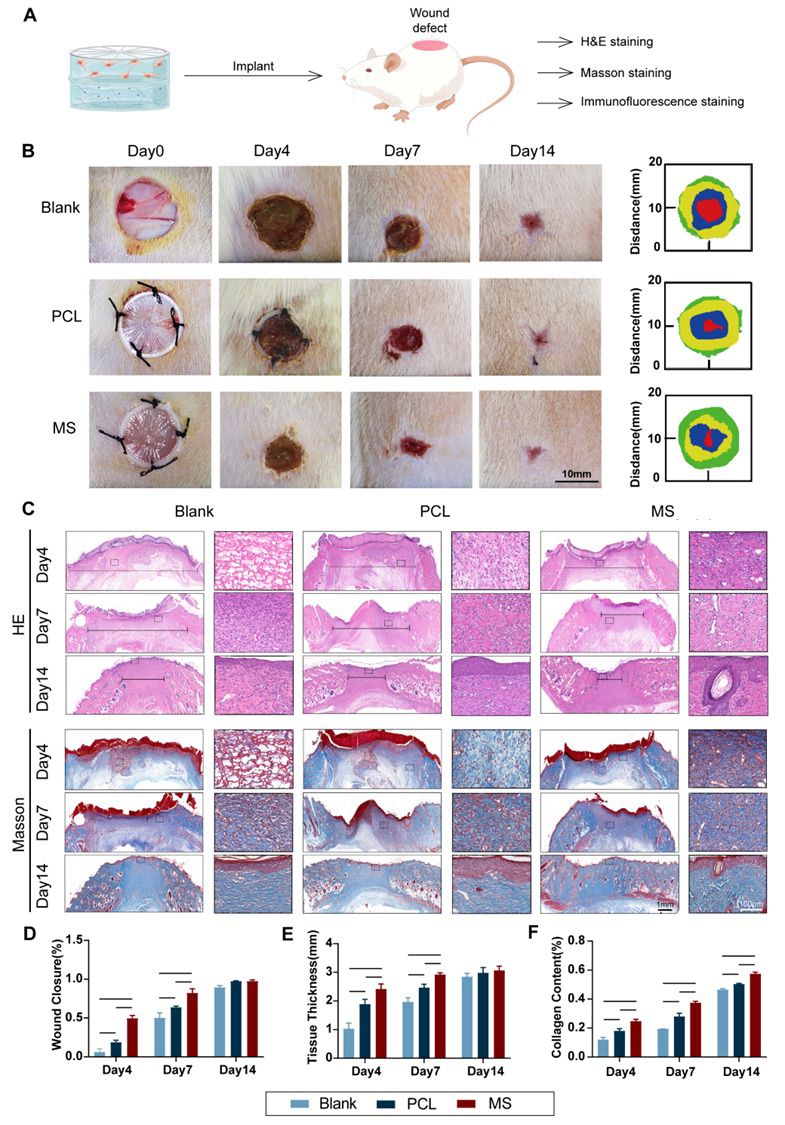
图6 仿生皮肤促进伤口愈合的体内实验评估
5.仿生皮肤促进伤口修复体内实验 使用大鼠的全层皮肤缺陷模型在体内评估仿生皮肤的功效(图6.A, B)。通过将PCL膜的外框缝合到伤口边缘周围的正常皮肤上,将完整的仿生皮肤与身体结合在一起。缺损区与仿生皮肤的直径差异使PCL膜在早期持续拉伸周围皮肤,并通过缝合的预张力加速伤口闭合。同时,水凝胶不断释放生物刺激以促进组织再生。因此,仿生皮肤通过结合机械和生物机制促进伤口闭合和修复。 利用H&E和Masson染色进行组织学评估(图 6.C-F)。MS组显著促进肉芽组织再生,加速了胶原蛋白沉积,促进了伤口的修复。免疫荧光染色也证实了MS组具有最快的血管化和再上皮化进程(图7)。 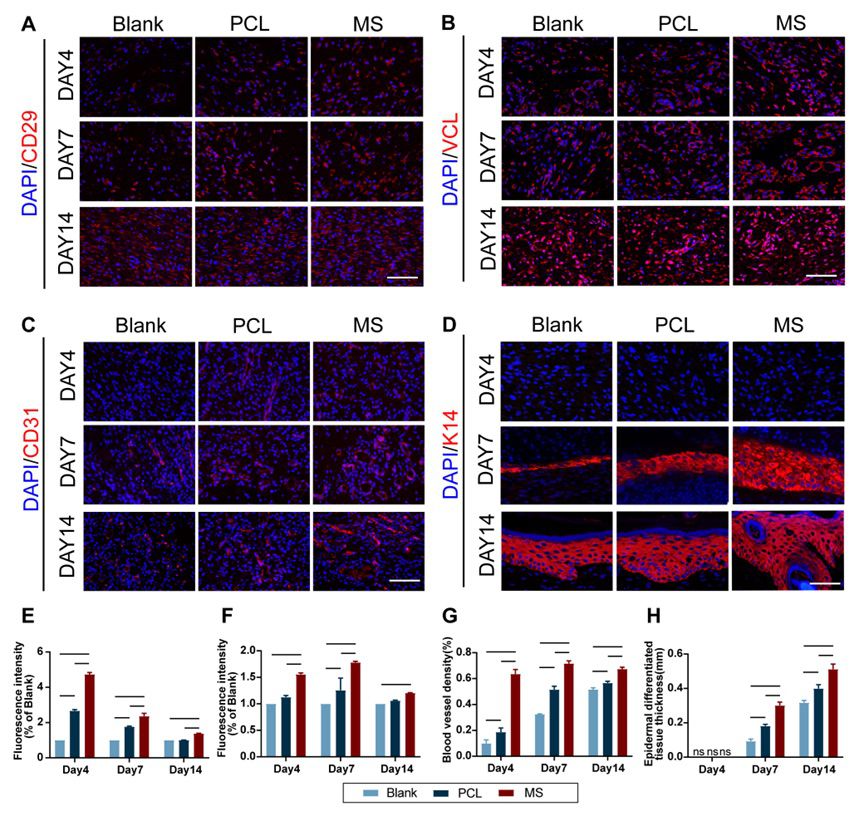
图7 体内实验的免疫荧光染色结果
综上,这项研究设计开发了一种PCL/GelMA/HAMA/PRP仿生皮肤。通过模拟皮肤结构和伤口修复的生理过程,仿生皮肤有效地促进了伤口的早期闭合和快速愈合。在伤口修复的初始阶段,仿生皮肤的膜框架通过预张力帮助伤口闭合,同时细胞在水凝胶内增殖。随着时间的推移,框架逐渐降解,细胞从水凝胶中释放并沿着残留的膜迁移。整个过程中,皮下层水凝胶持续释放细胞因子,确保伤口得到全面的营养供给。这项研究不仅为皮肤损伤的治疗提供了新的解决方案,也为组织再生工程开辟了新的可能性。 文章来源: https://doi.org/10.1002/smll.202310556 (责任编辑:admin) |